染色质重塑作为近年来国自然热点之一,虽然不像细胞死亡或者免疫调控那么热门,但是染色质的动态调控对于生物遗传具有重要的意义,所以染色质重塑经过这几年的发展,未来一定会是一个持续的研究热点。
(图片来源于网络)
今天我们通过两篇高分文章对于染色质重塑的研究进行分析,为大家后续的研究提供一些思路。
染色质重塑是和DNA甲基化和蛋白质修饰一样的可以对染色质进行影响变化的一种机体行为,但是因为一直不清楚染色质重塑的具体机制,所以研究进度较慢。直到近些年冷冻电镜的发展,让人们可以对染色质重塑的结构有了认识,从而可以对机制有了更深的研究。
例如BAF(BRG1-associated factors)和PBAF(polybromo-associated BRG1-associated factors)复合物是人类染色质调控因子,他们可以调控染色质结构变化从而影响基因表达。据目前研究发现,该复合物广泛参与动物细胞的发育分化过程,并且BAF/PBAF的突变会导致很多癌症及其他疾病。虽然科学界很早就发现鉴定了BAF/PBAF复合物,但是对于复合物的组合方式和对染色质重塑的影响机制一直不是很明确。正是近几年得益于冷冻电镜技术,酵母SWI/SNF家族复合物及人源BAF复合物的高分辨结构先后在2019和2020年得以报道。然而对于PBAF复合物的研究,结论尚少。
我们首先要看的这篇文章就是清华大学生命科学学院/结构生物学高精尖创新中心/清华-北大生命科学联合中心陈柱成教授研究团队在《自然》杂志在线发表的题为“Structure of human PBAF chromatin remodeling complex bound to a nucleosome”的研究论文。

陈柱成教授团队近年来一直致力于染色质重塑的研究,得到了很多研究成果,解释了染色质重塑的一部分机制。在之前的研究中,陈教授团队在酵母中发现了染色质重塑SNF2家族的马达蛋白是利用ATP水解产生的能量推动核小体的变化,从而实现对染色质的调控,了解到了基本的原理,此次更是突破技术难点通过体外重组的方法获得了高质量的PBAF复合物,并且报道了他们研究人源染色质重塑复合物PBAF在活性状态下结合核小体的结构,揭示了由12个亚基组成的PBAF复合物的组装方式,以及PBAF复合物识别核小体的机制,为后续人类疾病相关突变的致病机理提供了理论框架。
文章主要内容
01
PBAF复合体的整体结构
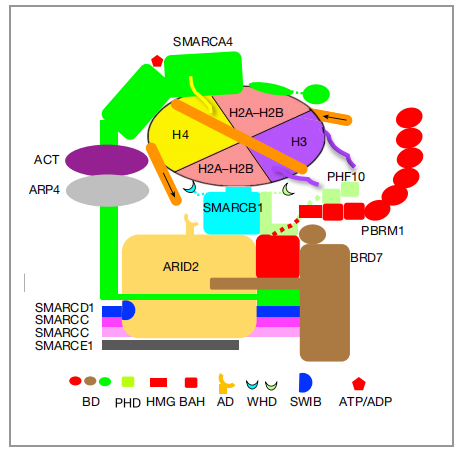
图1 与核小体结合的PBAF的结构示意图。箭头指示motor驱动的DNA易位的方向。ACT, β-actin; AD, arid domain; ARM, armadillo repeats; BD, bromodomain; CC, coiled coil; FH, finger helix.|图片取自文章
PBAF复合物的12个亚基可分为SMARCA4和11个辅助亚基(分别是:SMARCC1、SMARCC2、SMARCD1、SMARCE1、SMARCB1、ARID2、PHF10、PBRM1、BRD7、ARP4、ACTIN),他们分别有各自的功能,作者为了可以明确的把他们的功能区分开,把PBAF复合物的12个亚基,分为了3个模块(图2,a、b):1)发挥催化功能的马达(motor)模块2)调节肌动蛋白相关蛋白(ARP)模块3)染色质靶向模块(SRM)。

图2 a)人类PBAF与核小体结合的冷冻电镜结构图,包含核小体和结合核小体的3个部分(motor, ARP and SRM) b)PBAF的两个模型图 |图片取自文章
02
染色质识别SRM模块
PABF的大多数辅助亚基复杂的交织成负责识别核小体信号的SRM(图3,a),其中包含支架亚基SMARCC1和SMARCC2,转录因子结合亚基SMARCD1和SMARCE1,DNA结合亚基ARID2、组蛋白尾部结合亚基PBRM1、BRD7和PHF10,以及核小体结合亚基SMARCB1。并且他们形成明显的三叶状亚模块:核小体结合叶片(nucleosome-binding lobe,NBL)、组蛋白尾结合叶片(histone-tail-binding lobe,HBL)和DNA结合叶片(DNA-binding lobe,DBL)(图3,b)。其中结合组蛋白尾部的HBL是区别于BAF独有的一个亚模块,包含PBRM1、BRD7和PHF10(表1)。文章认为,这相当于一个超级组蛋白识别亚模块,有利于PBAF复合物在机体中更高效地感知染色质信号,发挥染色质重塑功能。文章分析了PBAF结合转录因子(TF)来调控基因表达的可能机理,同时也揭示了ARID2、PBRM1等亚基位点突变致病的可能机理。
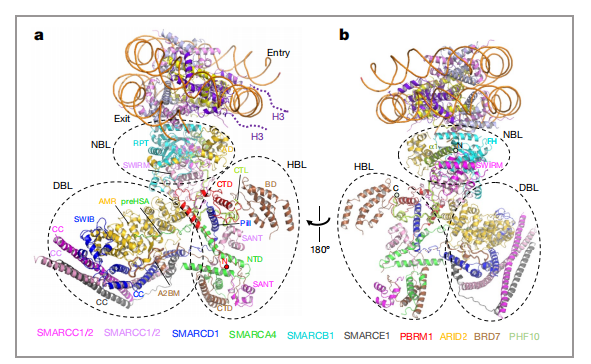
图3 a)和b)SRM的两个模型图,虚线椭圆代表参与核小体招募的三个叶状亚模块 |图片取自文章
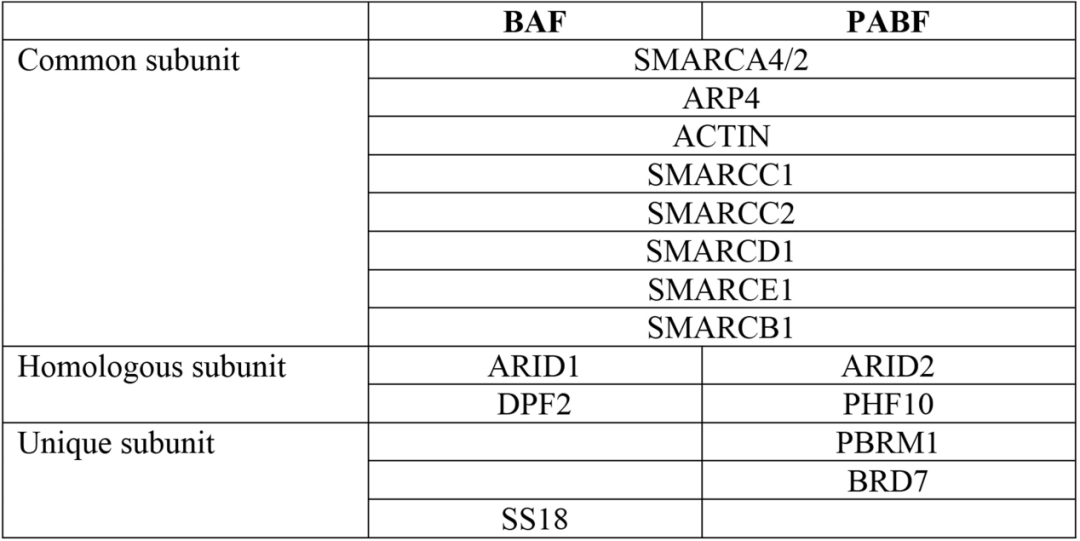
表1 BAF和PBAF的亚基差别 |表格取自文章
03
活性SMARCA4的马达结构
因为PBAF复合物的低分辨率结构和人BAF的高分辨率结构在之前已经被报道过了,所以本篇文章在此基础上,利用冷冻电镜技术,主要解析了PBAF结合核小体的高分辨率结构(3.4埃),并且在马达亚基SMARCA4的解析达到了2.8埃(图4),由此可以清楚的观察到催化ATP口袋和支撑螺旋(Brace-Helix)。支撑螺旋在染色质重塑中起到至关重要的作用,该结构介导了两个马达结构域(Lobe1与Lobe2)的相互作用,是耦合ATP水解和核小体滑动的关键(图5、6)。
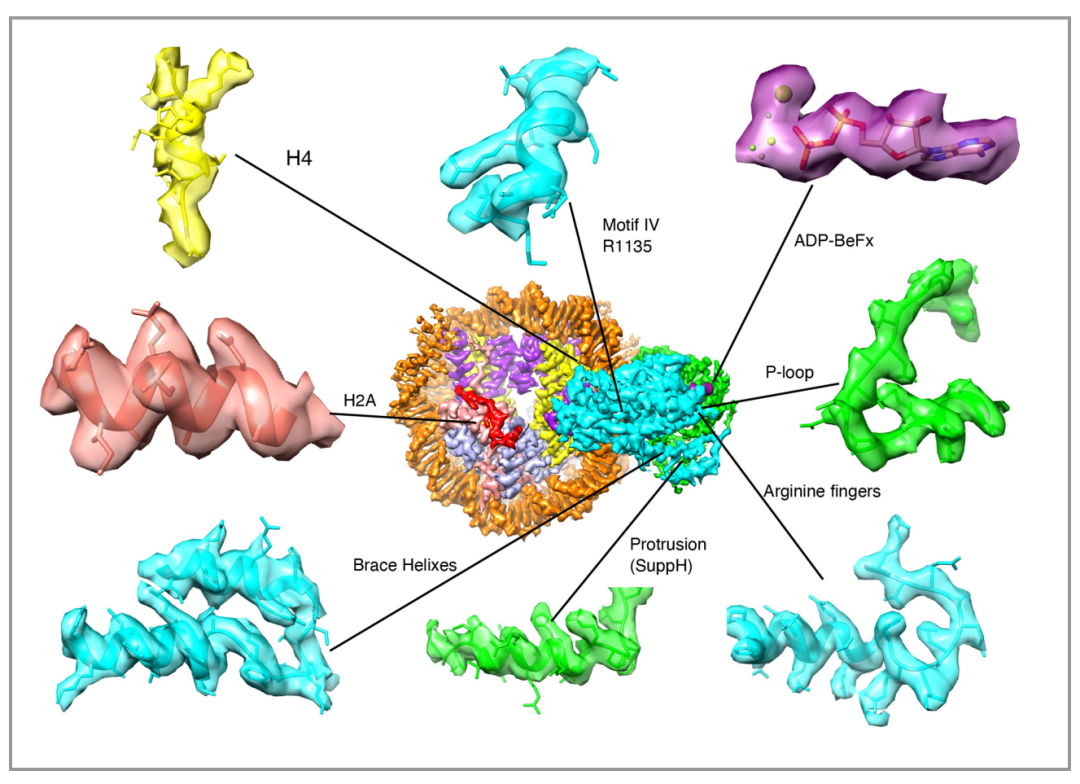
图4 分辨率为2.8埃的motor模型冷冻电镜图 |图片取自文章
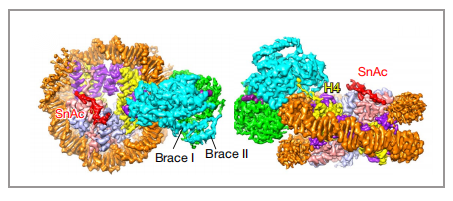
图5 与核小体结合的motor结构域的局部图谱。Lobe1, lobe2和SnAc域分别显示为绿色、青色和红色 |图片取自文章
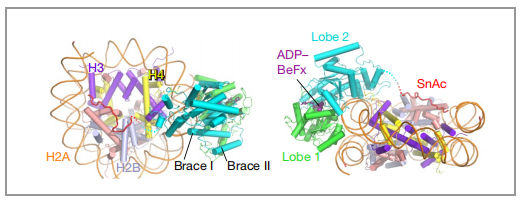
图6 与核小体结合的motor模型图 |图片取自文章
SMARCA4的运动结构域采用封闭构象,并与核小体紧密结合,这与之前报道的BAF的结构不同,说明了本研究解析的复合物中马达亚基SMARCA4处于活性状态。SMARCA4的活跃构象导致经常发生突变,然而我们可以将与疾病相关的突变映射到功能状态上。突变主要集中在两个位点上,一个在高度保守的ATP结合口袋周围,另一个围绕在新形成的支撑螺旋(Brace-Helix)周围。这些突变会导致染色质重塑活性明显降低,所以这些突变有可能导致PABF功能的丧失从而导致某些疾病。另外,高质量的电镜密度首次揭示了SMARCA4亚基的SnAc 结构域识别核小体的机制:SnAc通过3个精氨酸锚点识别核小体的酸性口袋,促进染色质重塑活性(图7)。
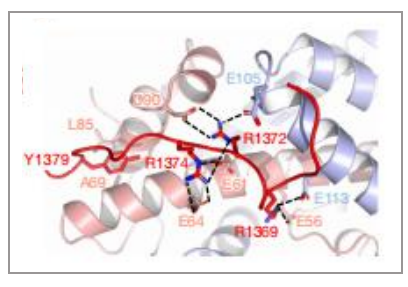
图7 SnAc结构域与核小体的酸性口袋之间的识别结合 |图片取自文章
总结
本篇文章不仅为PBAF复合物组装、核小体识别和染色质重塑机制提供了机制上的见解,也为PBAF复合体多个亚基经常发生突变导致的人类疾病机理提供了理论基础,更有利于后续理解染色质重塑研究,并且有可能推动相关疾病靶向药物的研发。

