成年鼠脑高活性神经细胞分选全攻略 | “小优带您做分选”线下邀约
神经学研究需要细胞水平的基础研究模型,但原代神经细胞制备与其他细胞类型相比面临更多挑战:
脑组织来源稀缺,解剖精细复杂,细胞数量要求高;
成年鼠脑髓鞘多,需去除解离后碎片;
对机械和酶消化敏感,易破坏细胞形态;
离体后神经细胞易发生凋亡,活性低;
神经细胞分选难度大,纯度和得率不理想。
原代神经细胞的高质量单细胞悬液是后续分选、培养等实验步骤成功与否的重要前提。目前,新生脑组织因其细胞特性常被用于获取原代神经细胞的优选材料。然而在模拟成熟神经系统疾病的研究中,成年脑组织具有不可替代的价值,是研究阿尔茨海默病、帕金森病及精神分裂症等成年神经系统疾病的金标准模型。
两者在样本处理流程中的对比总结:
|
样本 类型 |
新生脑组织(胚胎期或P0-P7) |
成年脑组织(>P7) |
|
核心优势 |
解离难度低 细胞活性高 神经元比例高 |
生物相关性高、 细胞类型保留完整 |
|
典型应用 |
神经发育研究 原代神经元培养 |
神经退行性疾病 细胞互作研究 |
|
技术关键 |
动物日龄-严格统一取材日龄 酶解时间-避免过度消化 机械解离-温和轻柔 |
酶解方案-复合酶或解离试剂盒 机械解离-强力且温和 质量优化-去除碎片和红细胞 |
但实际操作过程中仍有很多tips要注意,如果对于上手实操还是没把握?线下体验日之“小优带您做分选”可帮您解决燃眉之急~
小优带您做分选
线下活动日,火热进行中!
“小优带您做分选” 系列活动已于 2025年7月正式启动!我们已经深入各大高校实验室,为您制定专属的一站式服务:
定制理论讲座: 针对您的实验痛点和样本类型定制专题讲座。
实验demo: 技术专家现场指导,从组织解离到磁珠分选,全程带教!
专属资源:线上专属技术交流群&精美小礼品
我们的足迹(持续更新中):
01
上海交通大学-
成年鼠脑组织解离 + 小胶质细胞分选
02
中科院营养与健康所
小鼠心脏灌流实验全流程
03
同济大学
人脑组织细胞核提取技术
04
中南大学湘雅医院
成年鼠脑组织高效解离方案
01
上海中医药大学
20例小鼠肿瘤样本高通量解离
左右滑动查看更多
扫描文末海报二维码,即可参加【小优带您做分选】线下体验日活动。
在【小优带您做分选】活动中,我们使用美天旎成年脑组织解离试剂盒搭配全自动组织处理器获得单细胞悬液,进行小胶质细胞的提取,实验结果相比与传统手动处理有着明显优势。接下来小优将以美天旎产品为例,带您深度解析成年鼠脑组织解离+质量优化+神经细胞分选的实验操作,助力您的实验结果!
|
样本制备 |
质量优化 |
磁珠分选 |
|
成年脑组织解离试剂盒 |
碎片去除试剂 |
CD11b磁珠 |
|
全自动组织处理器 |
红细胞去除试剂 |
手动分选套装 |
样本制备
成年鼠脑组织解离试剂盒Adult Brain Dissociation Kit 130-107-677
01
试剂盒说明(试剂盒共有7个试剂瓶)其中包含:
成分:
❖
2.5 mL 酶P
❖
2×50 mL Buffer Z(无菌)
❖
1.5 mL Buffer Y (无菌)
❖
1瓶 酶A (冻干粉)
❖
5 mL 红细胞裂解液原液 (10×) (无菌)
❖
45 mL 碎片去除试剂(无菌)
(在旧批次的试剂盒中,批次号后三位在860之前的试剂盒有8瓶试剂,使用buffer A 配置酶A,新批次试剂盒中没有buffer A)
规格:
试剂盒可做50次实验(脑组织平均重量为 20 – 500 mg)
储存:
酶P在-20°保存;其他试剂均在4°保存。
02
所需试剂与仪器
❖
gentleMACS 八通道带加热模块组织处理器(130-096-427)
❖
gentleMACS C管(130-093-237)
❖
细胞筛网MACS SmartStrainer (70 μm) (# 130-098-462)
❖
含有钙、镁、葡萄糖和丙酮酸的磷酸盐缓冲盐水 (d-pbs),4℃保存
❖
PB 缓冲液(PH 值 7.2,含 PBS 和 0.5%的牛血清白蛋白):用 PBS 以 1:20 的比例稀释 MACS 牛血清白蛋白原液(MACS BSA Stock Solution,130-091-376)。
注意:缓冲液保存预冷状态(2-8℃);使用新鲜配制的缓冲液,不要使用 autoMACS ® Running Buffer 或者 MACSQuant ® Running Buffer,其中含有少量的叠氮钠,可能会影响实验结果。
❖
无菌的去离子水,用于酶A的溶解
❖
制备1 × 红细胞裂解液的纯化水 (例如,双蒸水 (ddH₂O))。
注意: 不要用去离子水稀释。
❖
直径 35 mm无菌培养皿
❖
15 mL 和 50 mL 的离心管及离心机
03
实验步骤
试剂准备:
· 为满足下游细胞分选实验和细胞培养实验,建议使用至少800mg成年鼠脑组织解离。
· 以下给出的体积是针对一个成年鼠脑组织(400mg-500mg)加入1980μL 配置好的酶混合物。如果组织量少于400mg,建议使用同样体积的酶混合物。如果处理成年大鼠的脑组织或者不同脑组织区域,需要确定组织重量后按照比例调整所有的试剂体积以及总体积。
a) 酶p:即用试剂避免反复冻融,需将酶P分装后保存于-20℃,可稳定保存6个月。
b) 酶A:用1毫升无菌去离子水将冻干粉末重悬于酶A的瓶中,不要涡旋。分装后冻存于-20℃备用,避免反复冻融。
c) 酶混合物 mix 1 和酶混合物 mix 2 配置:

成年鼠脑组织解离操作步骤
· 每个C管最多可处理500mg的样本,最少处理20mg样本。
· 如下游实验对细胞进行培养,以下所有操作步骤需在无菌环境下进行
1. 取出小鼠脑组织,并用 D-PBS 清洗
2. 将适量的 Enzyme mix 1 加入到 gentleMACS C管中
3. 将脑组织取出放在培养皿里,用手术刀按矢状切成 8 块
4. 将脑组织块放入加有 1950 μL Enzyme mix1 的 C管中
5. 在 C管中再加入 30 μL 的 Enzyme mix 2
6. 盖紧 C管,然后将其倒插到 gentleMACS 八通道带加热模块组织处理器的套管中
注意:确认所有样本组织均处于酶溶液中。
7. 运行 gentleMACS 程序
20–100 mg: 37C_ABDK_02
>100 mg: 37C_ABDK_01.
8. 程序结束后,从 gentleMACS 组织处理器上取下 C 管。
9. 可短暂离心,使样本组织置于管底。
10. 重悬样本,将其吸出加到连接70 μm 滤器的50 mL 试管中,收集细胞悬液。
注意:
· 滤器使用前用缓冲液湿润。
· 如果试剂体积和样本总体积增加,需要增加滤器的用量。一个 70 μm滤器适用一个成年小鼠的脑组织量。
· >70 μm 的细胞可能会丢失,如需要这类细胞,可选择网格稍大的滤器
11. 用 10 mL 预冷(4℃)的 D-PBS 冲洗C管,通过滤器过滤。
12. 弃去滤器,将细胞悬液 300×g 离心 10 分钟,弃去上清。
质量优化
碎片去除
· 以下表格中的体积是针对20mg-1g组织(不超过 2 个成年小鼠脑组织)作为起始材料的细胞悬浮液。如果要处理较多脑组织,需要按照比例增加试剂用量和总体积量。
· 一个15 ml试管中最多处理1g神经组织 (2只成年小鼠脑) 的细胞悬浮液,或者在一个5ml试管中处理20-100 mg的细胞悬浮液。
·缓冲液和试剂在使用前都要进行预冷处理(4℃)
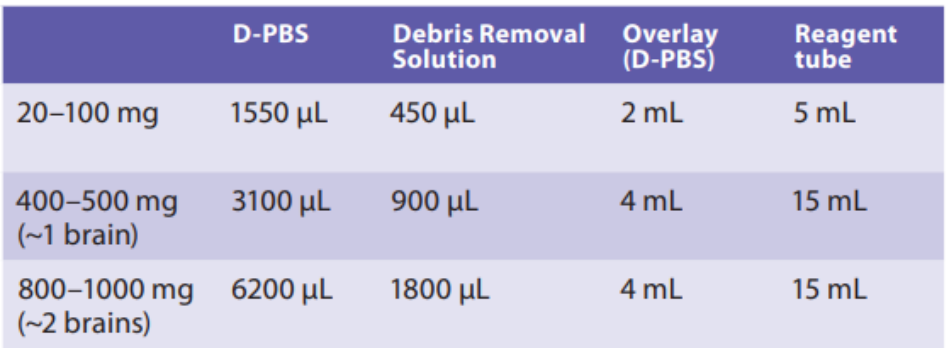
1. 根据上表,用适当体积的预冷D-pbs重悬细胞沉淀,并将细胞悬液转移到适当的试剂管中,不要剧烈震荡。
2. 加入适量的碎片去除试剂。
3. 充分混匀
4. 非常柔和缓慢的加入 4 mL 冷却的 PBS 覆盖
注意:加液时要非常的缓慢,确保PBS层覆盖在细胞悬上,两层不要混合。
5. 4℃,3000xg 全加速全刹车离心 10 分钟
6. 离心后溶液出现三层分层液,移除上两层
7. 加入冷却 PBS 溶液
8. 柔和翻转试管混匀三次,不要剧烈振荡!
9. 4℃,1000xg 全加速全刹车离心 10 分钟,完全移除上清液。
红细胞去除
a) 制备 1x 红细胞去除液
1. 用双蒸水(ddH2O)以 1:10 的比例稀释 10x 红细胞去除液。Eg:9 mL 冷藏的 ddH2O 稀释 1 mL 冷藏的 10x红细胞去除液
注意:不要用去离子水作为稀释剂!
2. 将 1x 红细胞去除液保存在 2 -8℃环境下。现配现用。
b) 红细胞去除
以下的液体体积是20 mg-1 g神经组织 (2只成年小鼠脑) 作为起始材料的细胞悬浮液。当使用较大量的起始材料时,需相应按比例放大所有体积。
1. 用适量的预冷 1x 红细胞去除液重悬细胞(≤2 个小鼠脑组织),不要剧烈振荡。
20–100 mg: 0.5 mL;100–1000 mg: 1 mL
2. 在 2 – 8℃的环境下孵育 10 分钟
3. 加入适量预冷的 PB 缓冲液
20–100 mg: 5 mL;100–1000 mg: 10 mL
4. 在 4℃环境下以 300xg 的速度离心 10 分钟。完全吸除上清液
5. 加入适量的缓冲液或培养基,用移液器小心缓慢的上下吹打重悬,不要剧烈振荡
6. 所得到细胞尽快用于后续实验
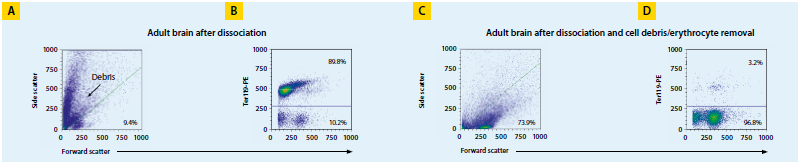
每只成年小鼠大脑可获得3-5×106个活细胞,且存活率可达到70-80%。
磁珠分选
小胶质细胞分选: CD11b MicroBeads, human and mouse(# 130-093-634)
01
磁性分选耗材
❖
MS分选柱(#130-042-201)或LS分选柱(#130-042-401)
❖
MS分选柱对应的Mini MACS分选器(#130-042-102)或OctoMACS分选器(#130-042-109);
❖
LS分选柱对应的Midi MACS分选器(#130-042-302)或QuadroMACS分选器(#130-090-976);
❖
MACS MultiStand(#130-042-303)
❖
MACS BSA Stock Solution(#130‑091‑376)和autoMACS Rinsing Solution(#130‑091‑222)1:20配置
❖
Pre-Separation Filters 30μm预分离滤器(#130-041-407)(可选,磁珠标记前去除细胞团,防止堵塞分选柱)
❖
如需进行去除分选,需选择LD分选柱,搭配Midi MACS分选器
02
实验步骤
一、磁珠标记CD11b细胞
1. 细胞计数;
2. 细胞悬液300×g离心10分钟,弃上清;
3. 细胞重悬,每1×107细胞添加90μL分选缓冲液;
4. 每1×107细胞添加10 μLCD11b MicroBeads磁珠;
5. 混匀,于2-8℃孵育15min;
6. 每1×10⁷个细胞加入1-2 mL分选缓冲液洗涤细胞,300×g离心10分钟,弃上清
7. 添加分选缓冲液,调整溶液体积至500 μL(注:500 μL体积最大重悬至1×108细胞,对于更多的细胞数量,需要相应提高缓冲液体积)
二、磁珠分选CD11b细胞
1. 将分选柱放入对应的MACS分选器的磁场中,如需详细分选柱信息请查看MACS分选柱载量数据表;
2. 用适量缓冲液润洗分选柱,等到分选柱中液体排空后,再进行下一步骤(MS分选柱使用500 μL分选缓冲液润洗;LS分选柱使用3 mL分选缓冲液润洗);
3. 将制备好的细胞悬液加入分选柱中,收集的流穿细胞液为未被标记的细胞;
4. 分别用分选缓冲液清洗柱子三次(MS分选柱使用500 μL分选缓冲液清洗3次;LS分选柱使用3 mL分选缓冲液清洗3次),收集未被标记的非CD11b细胞;
5. 从分选器中取出分选柱,将其放到合适的收集管上;
6. 吸取适量的缓冲液(MS:1 mL;LS:5 mL),加到分选柱中,立即将栓塞推入分选柱中,冲洗出磁珠标记的细胞,即为CD11b细胞;
7. 为了增加小胶质细胞的纯度,建议用两个MS或LS柱上样富集阳性部分。可使用新的分选柱重复步骤1至6中步骤。
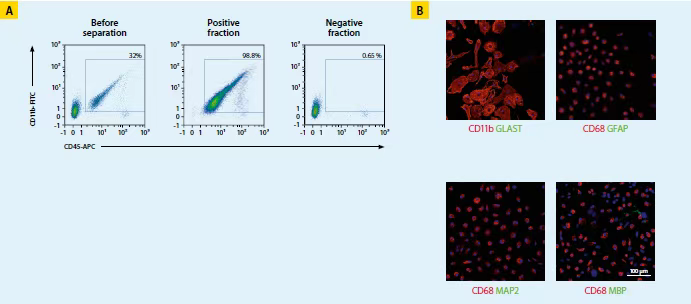
使用CD11b磁珠分选小胶质细胞。小胶质细胞纯度可达96.5±4.6%,存活率达到95.2±2.6%。分离后,每只小鼠全脑(n=4)产出4.2×105±1.6×105个小胶质细胞,每只成年鼠脑(n=2)产生2-3×106个小胶质细胞。
以上就是成年鼠脑解离+神经细胞分选的超详细实验流程!想了解更多关于脑组织解离及神经细胞分选的产品,小优为您总结了神经细胞分离&分选磁珠产品合集:
❶ 神经组织解离试剂盒:
|
分类 |
货号 |
品名 |
备注 |
|
所有神经 |
|
Adult Brain |
动物年龄>P7 |
|
|
Neural Tssue |
动物年龄≤P7 |
|
|
|
Neural Tissue |
||
|
仅神经元 |
|
Neural Tissue Dis |
动物年龄≤P7 |
|
特殊应用 |
|
Brain Tumor |
脑部肿瘤组织 |
|
|
Neural Tissue |
PSC来源的大脑类 |
|
|
|
Neural Tissue |
PSC来源的大脑类 |
|
|
|
Neurosphere |
培养的神经球 |
|
|
|
Embryoid Body |
体外生成的拟胚体 |
|
|
|
Myclin Removal |
单细胞悬液 |
❷ 神经细胞分选磁珠:
|
分类 |
货号 |
产品名称 |
|
星形胶质细胞 |
|
Anti-ACSA-2 MicroBead |
|
神经元 |
|
Adult Neuron Isolation Kit,mouse |
|
未成熟的少突 |
|
Anti-O4 MicroBeads, |
|
小胶质细胞 |
|
CD11b (Microglia) |
|
|
CD11b/c (Microglia) |



