文末一键获取WB实验超全技巧

荧光WB(Fluorescent western blotting)是指用荧光标记抗体来检测蛋白表达水平的WB技术。荧光WB有信号稳定、线性度好、可以多重检测这些优点,受到大家的欢迎,应用也越来越普及。但是,高背景问题限制了荧光WB的灵敏度。你在做荧光WB的时候,有没有被高背景困扰过呢?小优细节君就针对这个问题来分析讨论一下吧。
由于搭配了荧光检测系统,荧光WB中的背景比化学发光WB中的背景更为复杂。除了抗体与膜的非特异性结合引起的背景,还有自发荧光背景。封闭液、膜的种类和干湿差异、检测仪器的激发/发射条件,这些不同因素的组合将产生具体情况各不相同的背景。
膜
使用低荧光PVDF膜(FL)、NC膜和两个不同型号的PVDF膜做对比,结果显示,无论在哪个通道中,低荧光PVDF膜的背景都低至可以忽略。同时可以看出,在激发波长为635nm的Cy5通道中,普通NC膜和PVDF膜(B)的自发荧光最弱。
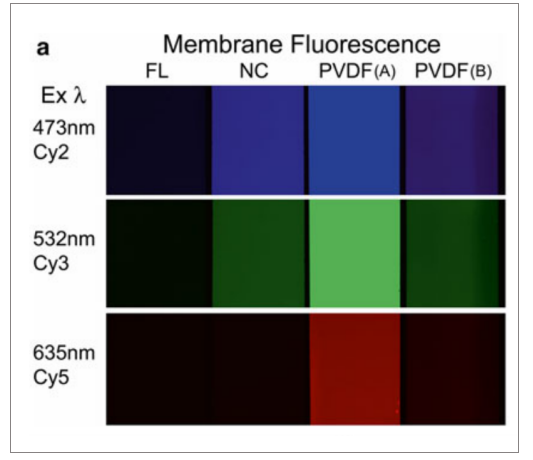
图1 低荧光PVDF膜有低背景(Ex: 473/532/635nm)
而在使用Odyssey 700nm和800nm这两个通道时,低荧光PVDF膜(LFP)的背景也明显低于NC膜。
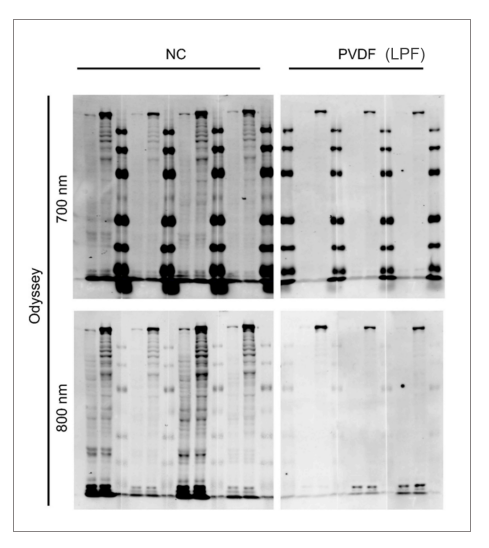
图 2 低荧光PVDF膜有低背景(NIR: 700/800nm)
封闭液
在荧光WB实验中,哪种封闭液的效果最好?这应该是大家最关心的问题了。对比仅用TBST(即没有封闭液)和BSA、牛奶、明胶、PVP这四种封闭液的效果,结果显示其它封闭液降低背景、突出特异性信号的作用并没有强于牛奶。考虑到经济因素,整体来看,牛奶仍然是封闭液的最佳选项。
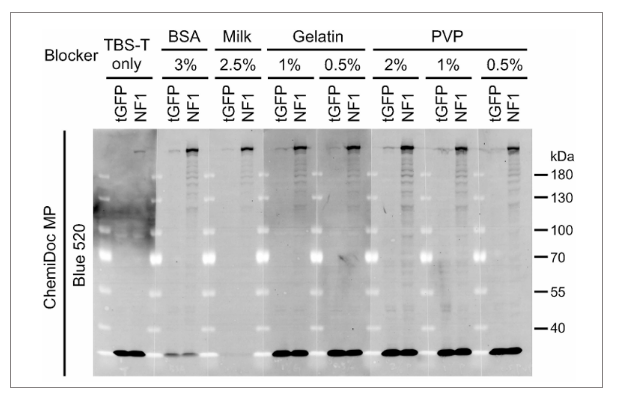
图3 不同封闭液效果对比
吐温20
在使用荧光WB法检测低丰度蛋白时,整体载量高且背景自发荧光较低的NC膜是一个折中的选择。为了获得更强的信号,试剂供应商会建议将膜干燥后成像,但同时需要去除封闭液中的吐温20,有一项研究解释了这样操作的必要性。
将膜在不同的液体中浸泡,分为三个处理组:水、TBST或TBST浸泡后水洗,模拟了WB实验中膜的使用场景。结果发现,使用不同的液体浸泡后,湿膜状态下检测到的背景值并没有很大差异,而膜干燥后,TBST组的背景明显偏高了。
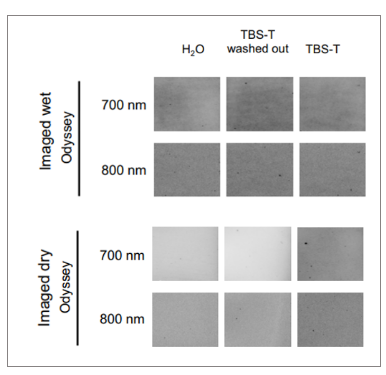
图4 去除TBST/吐温20可以降低背景
那么,我们来总结一下,荧光WB实验中,应该注意哪些条件,能降低背景呢?
01
膜的选择和处理
在检测高表达量的蛋白,希望有非常低的背景时,低荧光PVDF膜是首选。如果检测的靶标是低丰度蛋白,又考虑到价格成本,可以使用NC膜。相比普通PVDF膜,NC膜通常有更低的背景。
02
合适的封闭液
牛奶是非常容易获取且封闭效果好的封闭液,5%的浓度较为合适。也可根据使用的二抗和成像系统匹配的其它合适的封闭液,例如BSA、intercept。
03
吐温20添加
膜干燥后再成像能够增强信号,同时注意去除封闭液中的吐温20,否则可能引起高背景。
另外提醒大家,化学法WB和荧光WB各有其优点,如果荧光WB不能得到满意的结果,还是可以尝试化学发光检测。
部分推荐产品助力您的实验:
想了解更多WB实验技巧?
点此进入“小优细节君”专栏
获取往期干货内容!
小优细节君:把经验变成可复制的指南
“小优细节君”专栏内容由优宁维售后部主导输出,每月从超300例真实的售后咨询中筛选出科研人频繁遇到的共性问题,再而转化为可复制的实验指南。从热门靶点出发,解析机制原理、给出具体步骤、总结常见误区,帮助你把实验痛点拆解成可破解的细节!
专栏将持续更新,请关注“优宁维抗体专家”,实时掌握实验技巧!
参考文献:
Multiplex Fluorescent Blot Detection Guide : A Troubleshooting Guide, Bio-Rad.
📚点此直达【文献中心】:近百万高质量文献数据,每月5万+持续更新!
推荐阅读:
+
+
+

