细胞分离液产品是经典的无菌即开即用型密度梯度介质,可以根据细胞密度的不同从样品中分离出目标细胞,具有高活性,高纯度,高回收率等特点。

Ficoll Premium系列三款产品
Ficoll产品可以分为Ficoll-Paque Plus和Ficoll-Paque Premium两大系列,Premium系列是在严格控制的环境下生产的(符合ISO 13485:2003,依从美国药典章节<1043>的相关规定,具有法规支持文件 (RSF)),因此推荐可用作临床研究和细胞治疗,其成分与Ficoll-Paque plus没有区别。
此外,Ficoll-Paque premium产品具有1.077,1.084和1.073三种密度,为客户提供更多的密度选择。具体密度适用范围参照下表:
买细胞分离液找小优,即享68折扣!
10箱以上即享66折扣!快来选购吧!
产品选择指南:
|
货号 |
品名 |
规格 |
折扣价 |
适用细胞类型 |
|
FICOLL PAQUE PLUS 1.077 |
6X100ML |
1795 |
人外周血,脐带血,骨髓等样品中分离单个核细胞 |
|
|
FICOLL PAQUE PLUS 1.077 |
6X500ML |
6113 |
||
|
FICOLL PAQUE PREMIUM 1.077 |
6X100ML |
1876 |
||
|
FICOLL PAQUE PREMIUM 1.077 |
6X500ML |
6487 |
||
|
Ficoll-Paque PREMIUM 1.084 |
6X100ML |
2380 |
大/小鼠血液,骨髓,组织中分离单个核细胞。 |
|
|
Ficoll-Paque PREMIUM 1.073 |
6X100ML |
2380 |
分离人低密度细胞,如基质细胞,间充质干细胞。 |
|
|
PERCOLL |
250ML |
1965 |
通用细胞分离,可稀释成不同密度,可用来分离各种细胞及细胞器。如:中性粒细胞,单核细胞,肿瘤浸润淋巴细胞,巨噬细胞,病毒等等。 |
|
|
PERCOLL |
6X1L |
22032 |
||
|
PERCOLL |
1L |
3726 |
||
|
Percol1 PLUS 250 ML |
250ML |
2495 |
||
|
PERCOLL PLUS |
1L |
6874 |
细胞分离液的应用和使用方法小优之前也做过很多介绍,可以点击下方标题查看:
Percoll 、Ficoll 深度详解,让你的细胞分离不再难
今天小优继续为大家介绍使用密度梯度离心的方法(Ficoll,Percoll)分离循环肿瘤细胞(CTC)的策略。
循环肿瘤细胞CTCs简介
1869年,Ashworth,T.R等【1】首次在一例转移性肿瘤患者血液中观察到循环肿瘤细胞(Circulating Tumor Cells, CTCs)。CTCs即是指从原发肿瘤或转移灶脱落,进入血液循环系统的肿瘤细胞【2】,如图1。
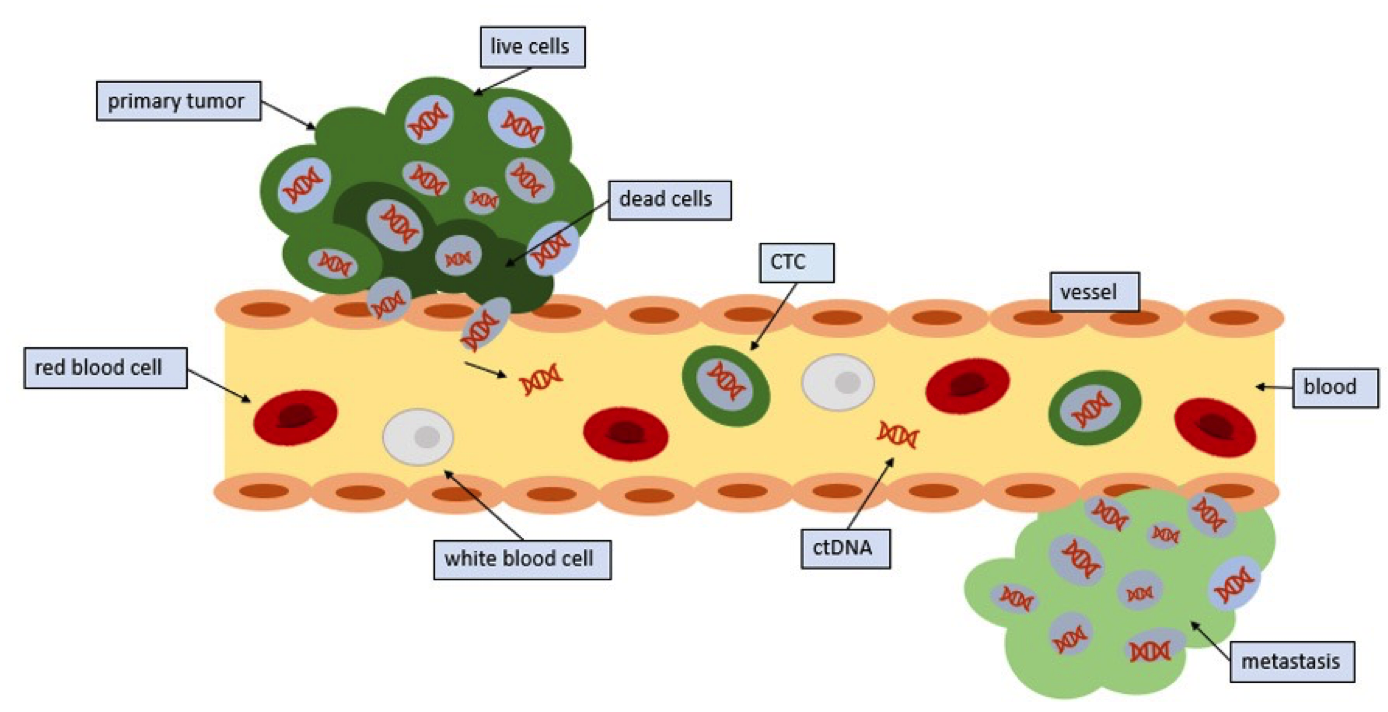
图1:循环肿瘤细胞CTCs进入血液循环
原发肿瘤释放CTCs进入循环中,大部分CTCs死亡,但是少部分CTCs存活并在远端形成转移灶【9】。
每天每g原位瘤可能会释放多达百万的肿瘤细胞进入血液循环【3】,但大部分因血流剪切力、失巢凋亡、免疫系统识别【4】而被清除,只有极少数(0.01%)【4】【5】存活下来,通过血液或淋巴到达远端器官形成新的转移灶,是肿瘤转移(Metastasis)和复发的重要生物学基础之一。
因此,CTCs是肿瘤精准医疗的重要靶点【6】,作为液体活检(其它如cfDNA、cfRNA、microRNA、外泌体、肿瘤代谢物)重要组成之一,其完整细胞的特有属性,允许通过表型、基因型(如单细胞测序)、细胞功能以及异种移植模型,用于肿瘤早期诊断、疾病进展、复发检测、转移癌监控、肿瘤亚型改变、耐药性研究以及预后评估【7】,促进个体化治疗实施。
此外,CTCs携带了肿瘤的基因组、转录组和代谢组等多组学信息,可用于研究肿瘤微环境、转移微环境PMN、免疫逃逸机制,还可用于培养类器官【8】进行体外药物筛选和检测。
CTCs的分离方法
CTCs的分离方法,主要分为非标记法和标记法,如图2。
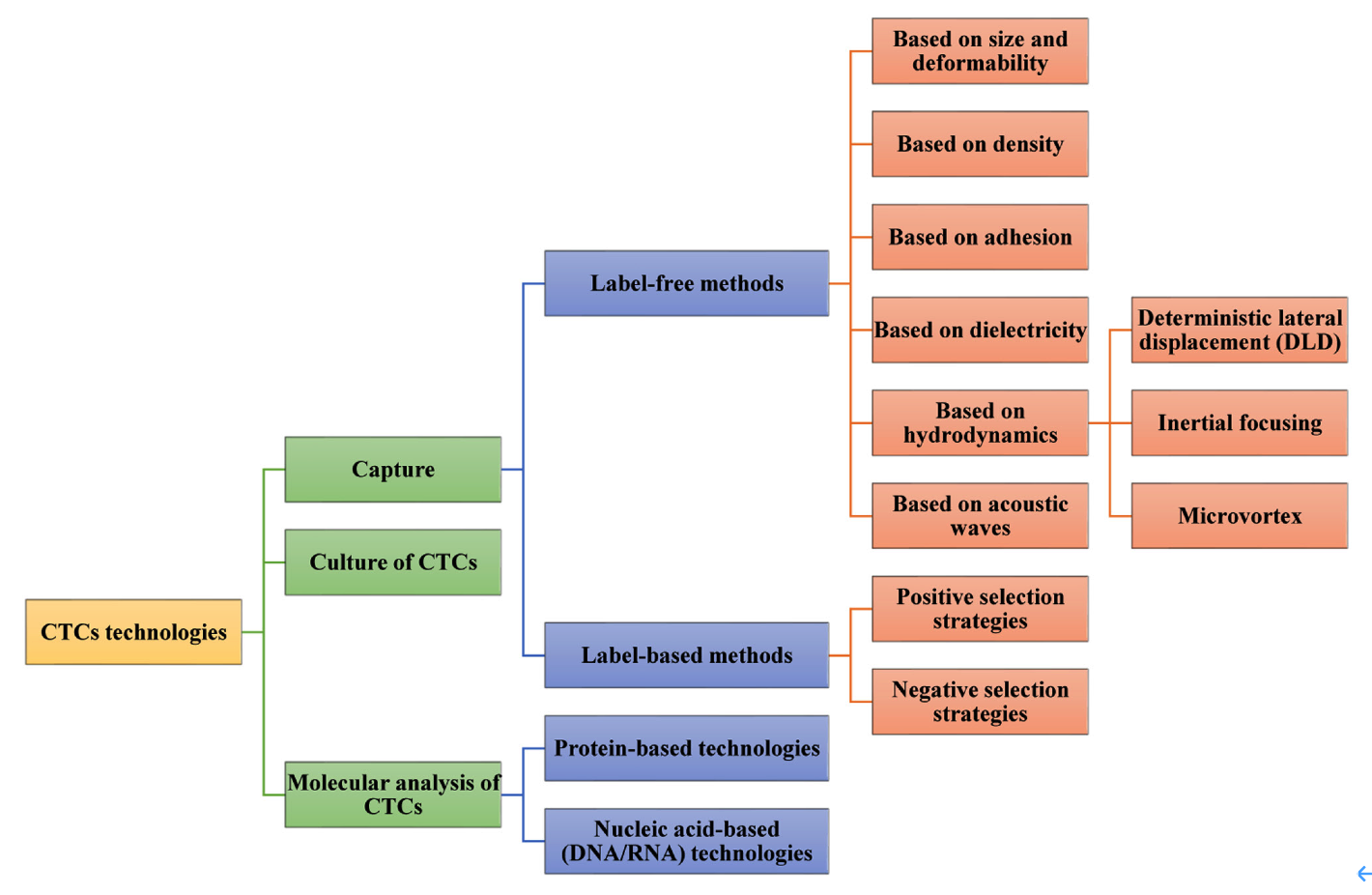
图2:CTCs分离、培养和分析方法【10】
非标记法
主要依赖CTCs自身的物理性质,如大小、密度、粘附、介电性质和变形性【11】【12】。被广泛使用的Cytiva Ficoll-Paque 和Percoll分离液即基于密度分离。大小和变形性等则常用于微流控技术【13】。
标记法
主要为阳性富集(如上皮细胞粘附分子EpCAM【14】、HER2、束丝蛋白3【15】、前列腺特异性抗原PSA【16】等或Cocktail)和阴性富集(如CD45抗体去除白细胞、CD61去除血小板和巨核细胞【17】、CD14等或Cocktail)。
基于抗EpCAM免疫磁珠技术的CellSearch CTC Test方法,是目前唯一被美国FDA批准作为肿瘤预后评估工具用于转移性乳腺癌(2004年)【18】、结直肠癌(2007年)【19】和前列腺癌(2008年)【20】。
中国CFDA在2012年批准了CellSearch系统用于转移性乳腺癌的预后评估。其它本土获批产品包括CytoSorter循环肿瘤细胞检测系统等,更多检测方法也在兴起和验证中。
CTCs的分离也可以联合非标记和标记法【21】,并受到肿瘤类型的影响【17】。
但是,CTCs分离仍面临挑战:
肿瘤细胞本身即具有异质性。并且,CTCs因上皮-间质转化(Epithelial-Mesenchymal Transition, EMT)失去极性和黏附性,获得更强的迁移和侵袭能力,与基质互作并抵抗治疗,同时表现出上皮和间质表型【22】,也造成细胞表面Marker的动态变化。此外,CTCs还会和血液中其它细胞如白细胞形成CTC微血栓促进自身生存和转移。
CTCs在血液中的密度很低,~1-10 CTCs/mL血液【10】,分离富集挑战大。一般,转移性癌症中每10 mL血液中有0-100个单体CTCs以及0-5个CTCs Cluster(CTCs簇),并与癌症类型、血液收集位置以及治疗阶段有关【23】。CTCs半衰期通常只有 1.0‑2.4 h【24】。
使用密度梯度离心法分离CTCs
早在1959年,Seal SH等【25】即使用硅油配制密度梯度离心介质,分离血液中的游离肿瘤细胞。
目前,商品化的梯度介质,如Cytiva的Ficoll-Paque进行CTCs的分离,在临床研究中被广泛使用【21】【26】【27】【28】。
作为非标记的分离方法,利于富集表面Marker表达异质性CTCs以及未知CTCs亚型,操作简单、低成本、快速,处理通量大。
使用密度梯度介质分离CTCs,文献报道中主要包括4种方法:常规标准操作、抗体预先结合杂质细胞、抗体预先结合CTCs目的细胞,以及使用Percoll不连续密度梯度进行分离。
使用Ficoll-Paque进行CTCs分离的常规操作
根据斯托克斯定律,如图3,颗粒的沉降速率v,和颗粒直径(d)、样品密度(ρp)和溶液密度(ρl)之差成正比;与溶液的粘稠度(η)成反比。当不同细胞经过同一密度离心介质,不同颗粒直径和密度的细胞,沉降速率不同,从而被分开。
外周血中,红细胞、粒细胞密度大【38】如图6,穿过Ficoll-Paque密度梯度介质(1.077 g/mL)沉于底层;外周血单个核细胞PBMCs和CTCs密度小,一起停留在白膜层(buffy coat)中,最上面是血浆。
后续可以使用阳性富集【29】或阴性富集(如anti-CD45磁珠去除白细胞)【30】【39】进一步回收CTCs。

图3:颗粒沉降速率公式【31】
Ficoll-Paque密度梯度介质标准操作及细胞分布,请参考文章:
☞ Ficoll-Paque应用解析:PBMCs分离中病人样本的特殊性
抗体结合杂质细胞后,再使用密度梯度介质分离CTCs
在密度梯度分离之前,进行杂质细胞预标记,促进其沉降。例如采用anti-CD45(白细胞共同抗原)【8】【32】【33】、anti-66b(粒细胞)与样品进行孵育,使白细胞与红细胞形成免疫玫瑰花状结构,密度和大小增加,在后续密度梯度离心过程中,将白细胞群拉到管底,则在白膜层可以回收更纯的CTCs,如图4,少量CTCs可能会渗漏到血浆层,也可以一起回收【6】【32】。
相对于阳性筛选,基于去除白细胞的阴性筛选更有优势,避免了使用抗体激活CTCs以及某些CTCs因为不表达相应的抗原而被遗漏【32】。
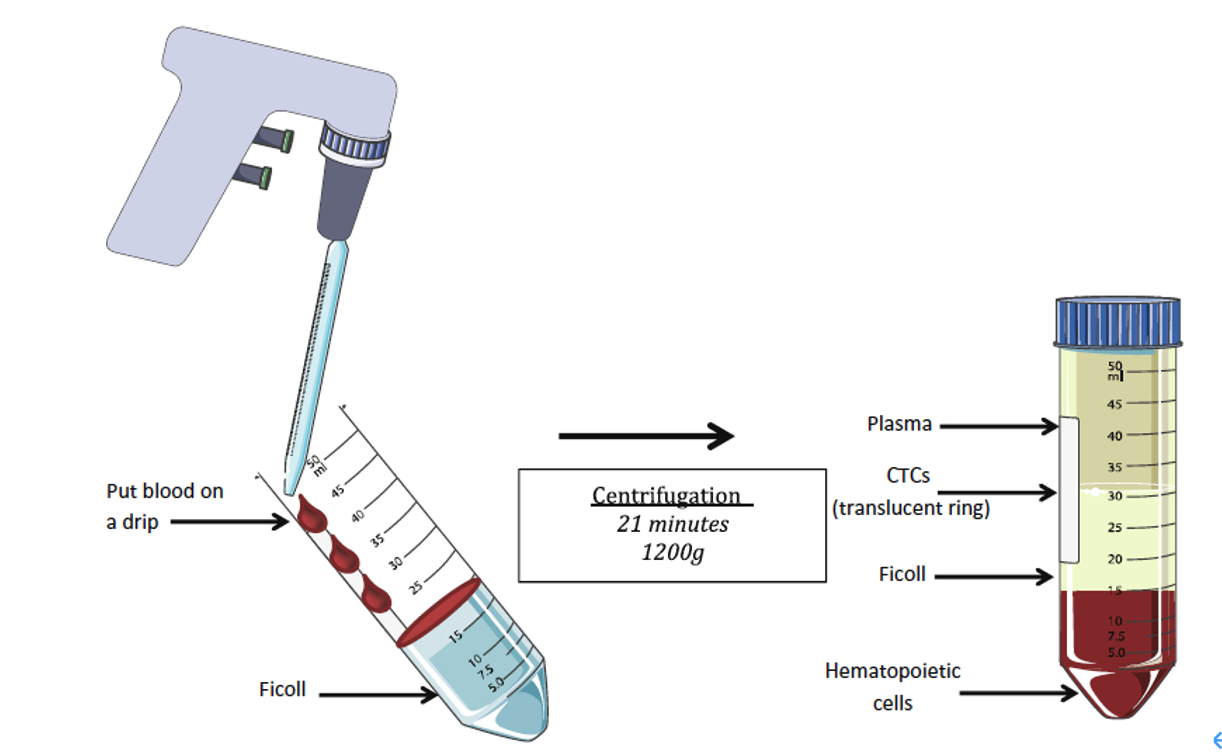
图4:使用Ficoll-Paque 密度梯度介质,分离CTCs
将血液和白细胞抗体如RosetteSep抗体孵育,使用DPBS+2% FBS稀释血样,然后小心地铺到Ficoll-Paque 密度梯度介质上面,离心(关闭刹车)后在白膜层收获CTCs【32】。
抗体结合目的CTCs后,再使用密度梯度介质分离CTCs
在密度梯度分离之前,进行CTCs目的细胞预标记,促进其沉降。
Huang Q等【34】使用同时偶联anti‑EpCAM抗体和anti‑CD146抗体(后者作为肿瘤标志物以及上皮间质转化EMT诱导剂,利于捕获EpCAM无/低表达间质CTCs)的SiO2微珠(表面包被可降解明胶),先和血样孵育以结合CTCs,之后将样品铺在Cytiva Percoll密度梯度介质(配制成1.15 g/mL)的表面,离心,CTCs结合在微珠表面而沉降于管底,之后酶解表层明胶释放CTCs,结果显示CTCs收率>80%,纯度大于85%,如图5。
也可以使用Ficoll-Paque密度梯度介质,采用类似方法离心沉降CTCs目的细胞,收集管底组分并裂红,回收CTCs。
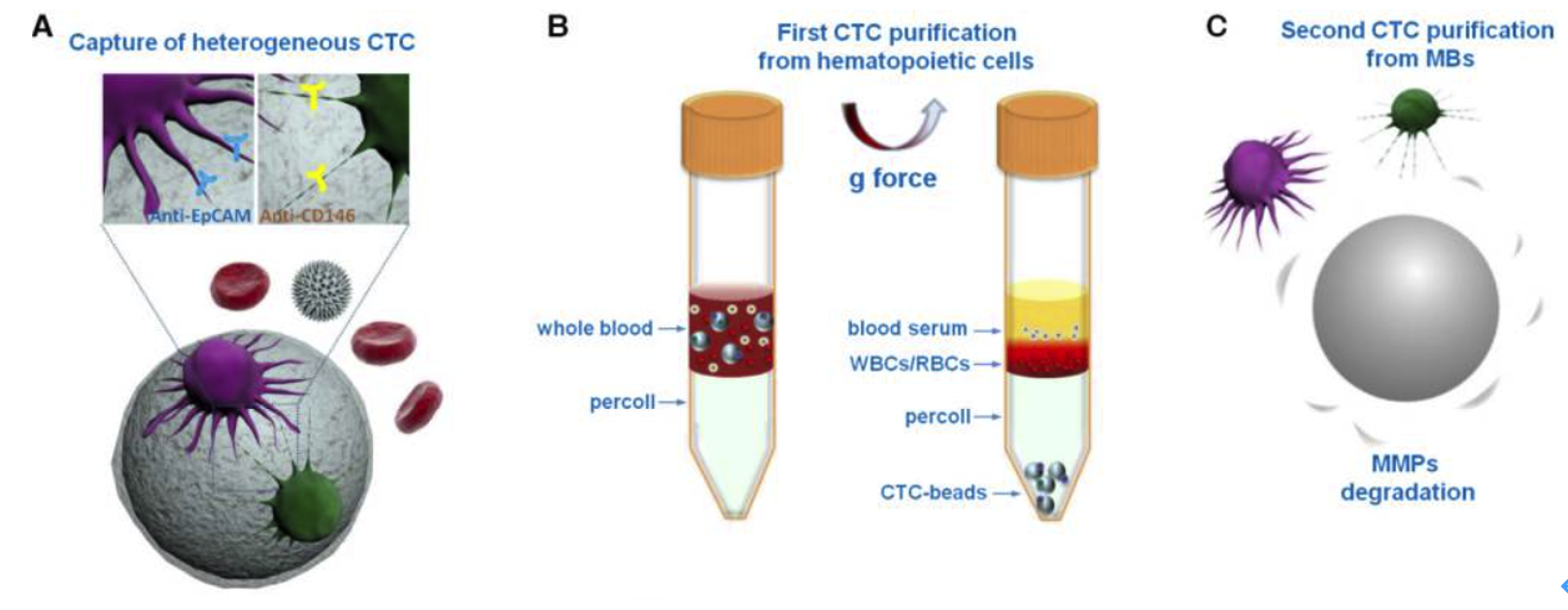
图5:基于微珠和密度梯度介质进行CTCs分离(部分图片)
A:通过可降解明胶包被的微珠(偶联了anti-EpCAM和anti-CD146抗体),高效吸附CTCs。
B:经过Percoll密度梯度离心,将结合CTCs的二氧化硅微珠沉淀到管底,从而和血细胞分离。
C:通过基质金属蛋白酶MMP-9酶解明胶,释放结合在微珠表面的CTCs。
除了CTCs单细胞外,CTC Cluster【35】以及CTCs与其它血液成分组成的细胞团,往往具有更高的转移潜能。由于细胞团的密度更大,容易在离心后沉降,也可以采用类似方法进行分离,或使用Cluster-Chip【36】。
另外,具有干性的CTCs,即循环癌干细胞(Circulating Cancer Stem Cells,CCSCs)同样值得关注。


