掌握这些细节,告别条带扭曲和低分辨率。
在分子生物学和蛋白质研究中,SDS-PAGE 是最基础却最容易翻车的实验技术之一。一个完美的条带背后,是无数细节的精准把控。下面我们将从原理出发,直击制胶、上样、电泳、染色全流程中的典型问题,助您一次性获得清晰可辨的电泳结果。
1. 基质组分(凝胶网络)
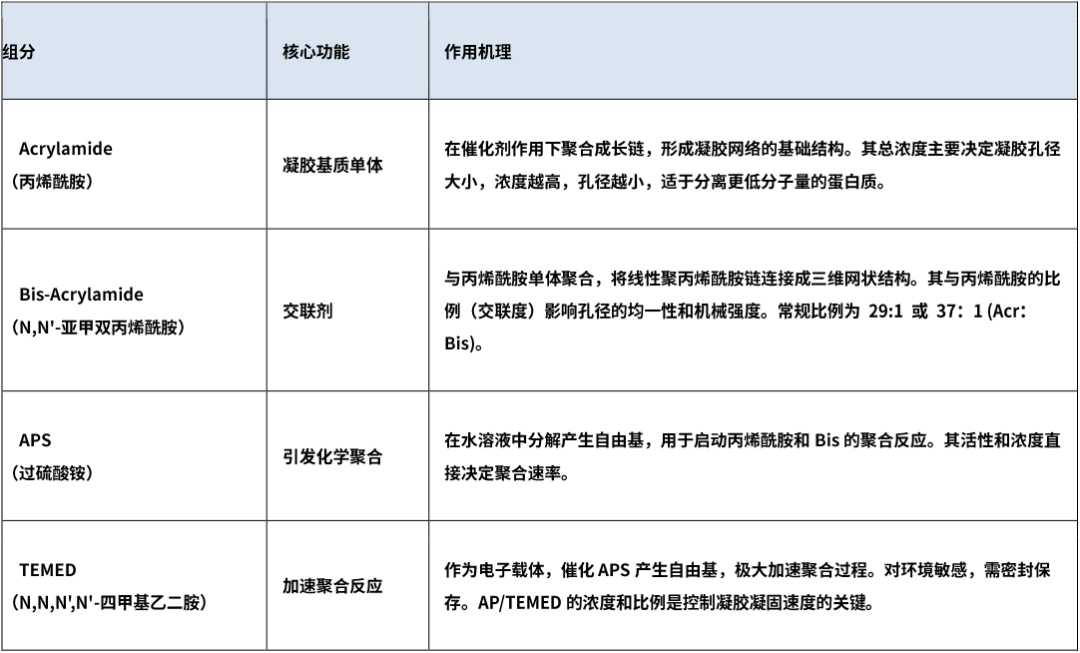
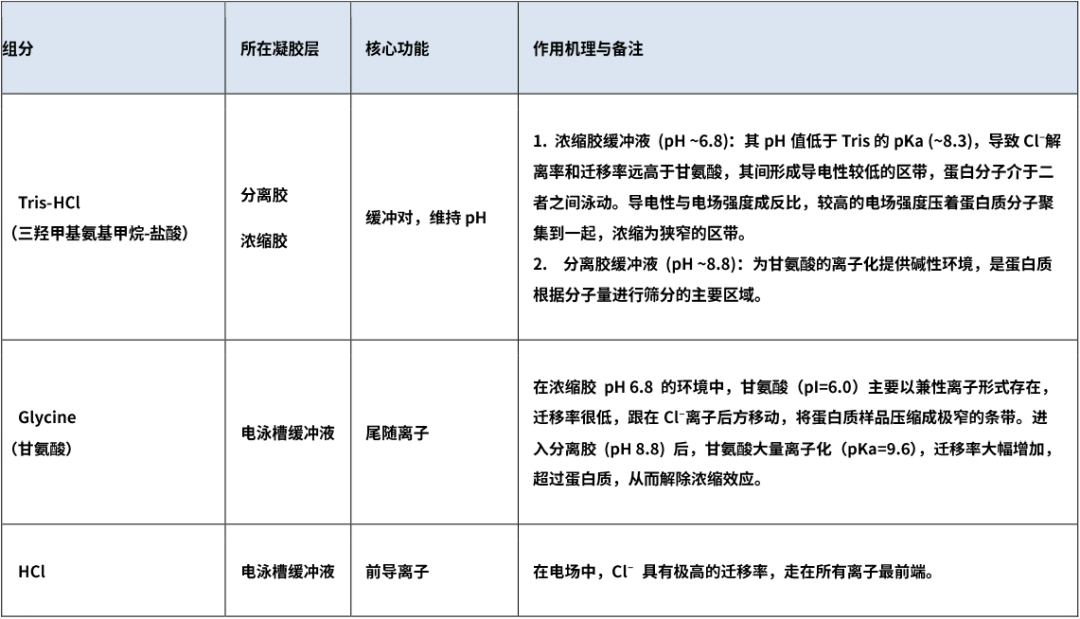
2. 缓冲组分(提供pH环境与导电离子)
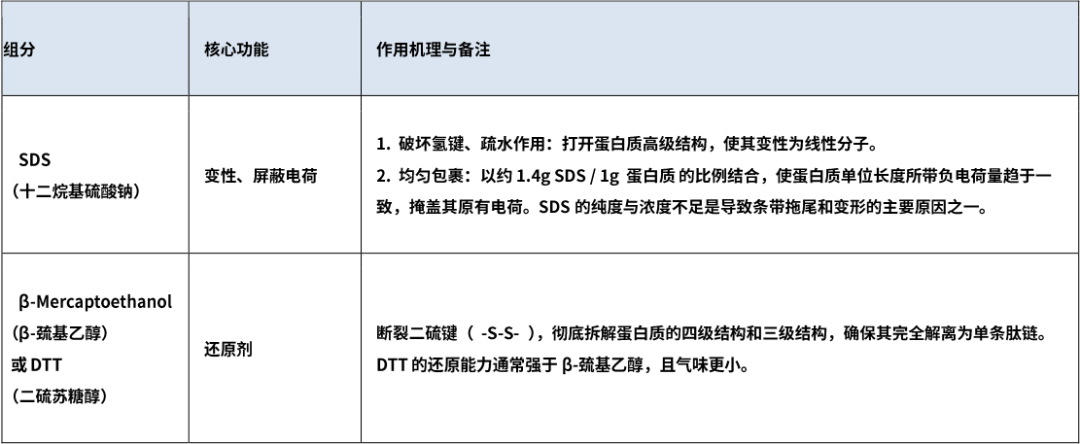
3. 变性还原组分(统一蛋白质电荷与构象)
1. 胶体凝固异常怎么办?
可能的状况1:不凝固
对策:环境温度低于 20℃ 时,按比例适量增加TEMED 和过硫酸铵(AP);冬季可将灌胶后的玻璃板置于 37℃ 培养箱加速聚合。
可能的状况2:凝固过快导致胶脆易裂
对策:减少 TEMED 和 AP 用量,尤其在室温高于 25℃ 时。
可能的状况3:浓缩胶粘稠不成形
对策:立即检查浓缩胶缓冲液 pH 值(应为 6.8),如偏离需重新配制。
2. 凝胶均匀性不好怎么办?
可能的状况1:“微笑”条带(两边翘中间凹):
原因:厚凝胶(>1.5mm)中部凝固不均。
对策:延长室温聚合时间至 1 小时以上,或 25℃ 静置过夜。
可能的状况2:“皱眉”条带(两边下垂中间鼓):
原因:玻璃板底部存在残留气泡。
对策:灌胶后轻敲板侧排除气泡,必要时注入缓冲液填充间隙。
3. 条带分辨率不高怎么办?
*聚丙烯酰胺的充分聚合可提高条带分辨率。
原因:①即配即用易导致凝胶凝固不充分。②4度冰箱冷藏储存导致SDS结晶,破坏凝胶均一性。
对策:①凝胶在室温凝固后,再放置 2-4 小时待其充分聚合。②避免冷藏储存未用胶。
1. 三种处理方法的选择(根据实验目标选择适当处理方式)
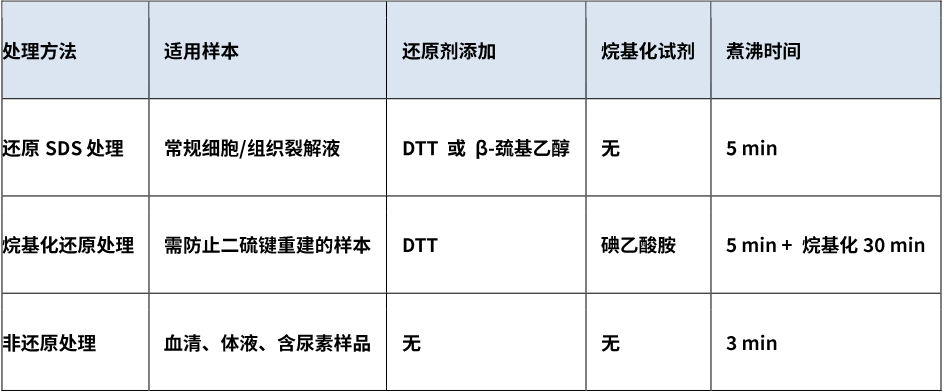
2. 典型问题
①“鬼带”:“鬼带”是指大分子蛋白(>100kDa)在加样孔底部形成沉淀或异常条带的现象。
成因:还原剂在加热过程中被氧化而失去活性,致使原来被解离的蛋白质分子重新折叠或亚基重新缔合成大分子,其分子量要比目标条带大,有时不能进入分离胶。但其与目标条带有相同的免疫学活性,在WB反应中可见条带。
对策:煮沸后补加 DTT或Beta巯基乙醇,或添加EDTA 抑制还原剂氧化。
② 最佳上样量:最佳范围为 20-50μg/孔。超过 80μg 将导致条带弥散;低于10μg可能检测困难。
③煮沸后处理规范:样品煮沸后需冷却至室温立即上样,避免冷藏或久置导致蛋白质再折叠。
④为什么条带出现拖尾现象?
原因:样品溶解不全或分离胶浓度过高。
对策:加样前离心;选择适当的样品缓冲液,加适量样品促溶剂(如0.5-1%脱氧胆酸钠);电泳缓冲液时间过长,重新配制;降低凝胶浓度。
⑤为什么条带出现纹理现象?
原因:样品中存在不溶性颗粒。
对策:增加超声破碎强度(30% 振幅,5 次×10 秒);加样前离心;加适量样品促溶剂。
1. 电泳条件标准
①电压梯度设置:
浓缩阶段:80V(约 20 分钟,至溴酚蓝成一线)
分离阶段:120V(约 90 分钟,至溴酚蓝达底部 0.5cm 处)
②温度控制:槽内温度需维持 4-10℃。过高将导致条带扩散(“微笑”带)甚至凝胶变形,建议使用循环水冷却系统。
2. 典型问题
①条带偏斜:检查电极是否平衡,加样是否垂直居中。
②溴酚蓝异常迁移:当染料跑出底线而蛋白未分离时,需降低分离胶浓度或更换正确pH值的缓冲液。
③电压高但电流低(<5mA):多为电泳槽装配错误,重点检查:内外槽是否装反、外槽液是否不足、底部绝缘橡胶是否未移除。
④条带过粗:增加浓缩胶长度至 1.5cm 以上;确认浓缩胶缓冲液 pH;降低浓缩阶段电压至 70V。
其他关键要点:
-
缓冲液 pH 是分离基础:浓缩胶 pH 6.8,分离胶 pH 8.8,偏差超过 0.2 需重新配制
-
还原剂活性决定解离程度:DTT 及 β-巯基乙醇需 -20℃ 避光保存,开封超过 3 个月建议更换
-
电泳缓冲液不建议回收:重复使用易引入杂质导致纵向条纹
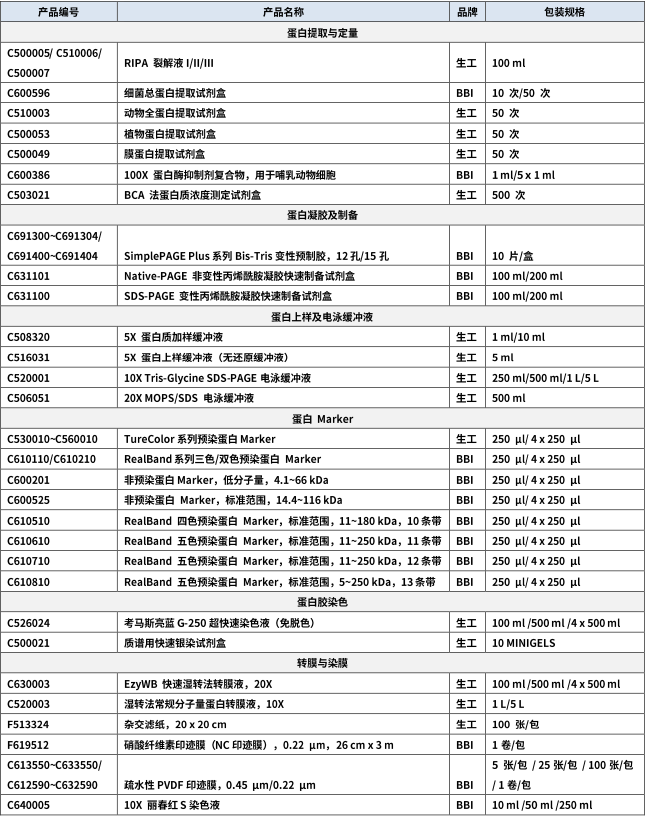
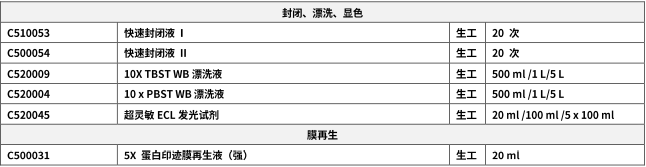
细节决定成败!掌握这些避坑要点,从此让扭曲的条带、模糊的结果成为历史。

