研究细胞凋亡信号通路,如同解开生命精心设计的“死亡程序”。一个清晰的思路能帮助我们层层深入:首先建立可靠的模型诱导凋亡,接着确认其典型表型,然后捕捉关键的分子差异,最终深入剖析其作用机制。本文即循此脉络,结合凋亡检测的关键技术与常见陷阱,为您的探索之旅提供实用导航。
🔔提示:由于干货较多,篇幅较长,阅读大约需15分钟,建议先收藏哦!
第一步
构建模型—启动凋亡程序
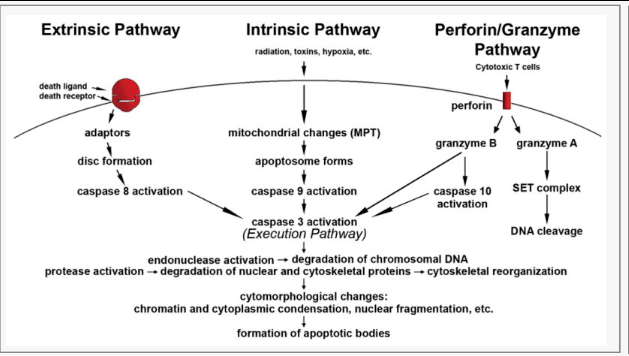
任何通路研究的起点,都是建立一个能稳定、特异诱导目标表型的模型系统。对于凋亡研究,这意味着选择合适的细胞类型和凋亡诱导剂。根据凋亡触发机制的不同,主要可分为四大类途径,选择合适的诱导剂至关重要。
细胞选择
依据研究目的,可选用原代细胞(更接近生理状态,但操作复杂)或永生化细胞系(易培养、重复性好,如HeLa, Jurkat, MCF-7等)。关键需确认:
❖
目标细胞是否表达相应途径的关键受体(如Fas/CD95对于外源性途径)。
❖
目标细胞对所选诱导剂是否敏感(如某些细胞系对特定DNA损伤剂有抗性)。
❖
研究穿孔素/颗粒酶途径,通常需要免疫效应细胞(如CTL, NK细胞)与靶细胞共培养系统。
诱导剂选择:
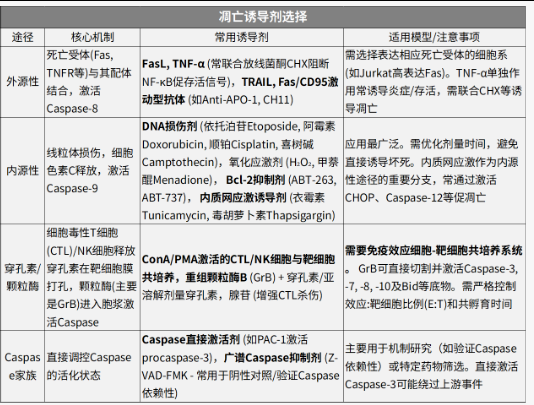
剂量与时间摸索:
这是模型成功的关键!需针对所选诱导剂和细胞类型,设置浓度梯度和时间梯度(如0, 6, 12, 24, 48小时),通过后续表型检测(如细胞活力CCK-8/MTS,或形态学初步观察)确定最佳诱导条件——既要达到显著凋亡效果(如20-50%凋亡率),又要避免大规模坏死干扰(PI单阳性细胞过多)。
模型构建的核心目标,是获得一批处于可控凋亡进程的细胞群体,并明确其触发的核心凋亡途径。
模型构建后,我们首先需要回答的问题是——凋亡真的发生了吗?它进展到了哪个阶段?这需要我们系统性地捕捉凋亡的“足迹”,即表型确认。
第二步
确认表型—捕捉凋亡的“足迹”
凋亡是一个多阶段、特征鲜明的程序性过程。表型确认旨在利用多种检测手段,从不同角度(细胞膜、细胞器、酶活性、细胞核)描绘凋亡的“肖像”,并判断其进程阶段。
早期表型:细胞膜与线粒体的警报
现象:磷脂酰丝氨酸(PS)外翻(丧失膜不对称性)、线粒体膜电位(ΔΨm)崩溃。
检测方法:
Annexin V/PI双染 (PS外翻)
原理:荧光Annexin V特异性结合暴露于细胞膜外的PS;PI渗透性差,仅进入死细胞。双染可区分正常、早期凋亡、晚期凋亡/坏死。
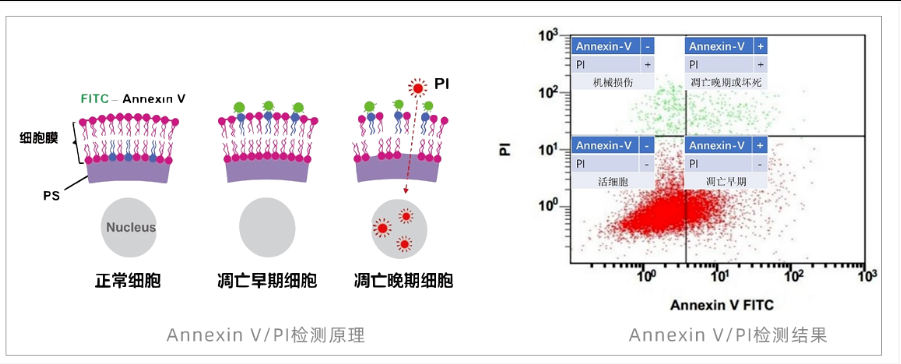

Annexin V/PI双染实验常见问题排查表
关键注意:
一活(细胞活性) → 二钙(缓冲液含钙) → 三对照(四对照齐全) → 四避光(全程避光操作) → 五调机(电压补偿校准)
C-1染色 (ΔΨm)
原理:正常线粒体时JC-1形成红色聚集体;ΔΨm下降时解聚为绿色单体。红绿荧光比值下降提示凋亡。
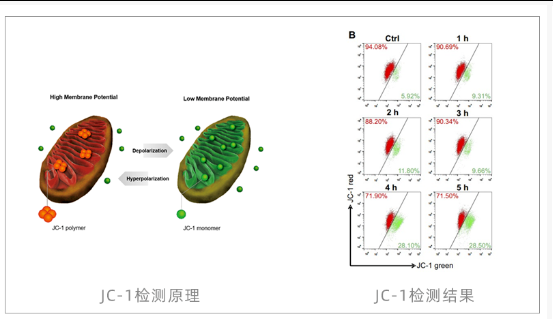
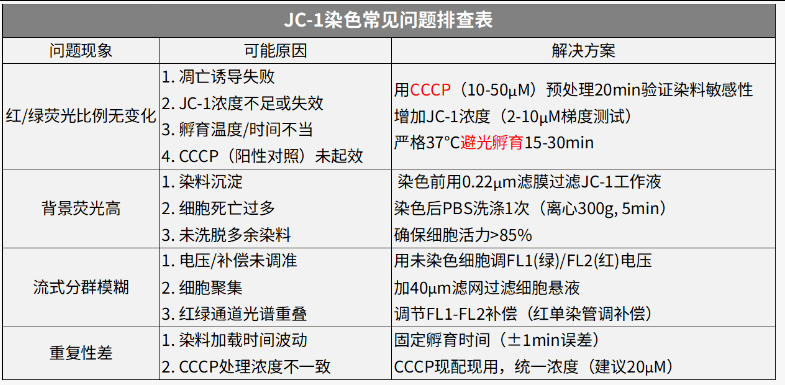
JC-1染色常见问题排查表
关键注意:
1、JC-1需避光现配现用(工作液30min内使用);2、设置CCCP阳性对照;3、分析时用红/绿荧光比值而非绝对强度。
执行期表型:Caspase的激活风暴
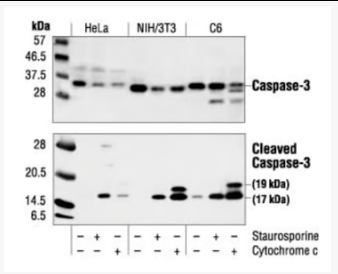
现象:关键Caspase酶原(如Caspase-3, -8, -9)被切割激活,底物蛋白(如PARP, 核纤层蛋白)被切割。
检测方法:
Caspase活性检测 (如Caspase-3/7)
原理:使用荧光底物(如DEVD-AMC),被活化的Caspase切割释放荧光基团,荧光强度反映酶活性。
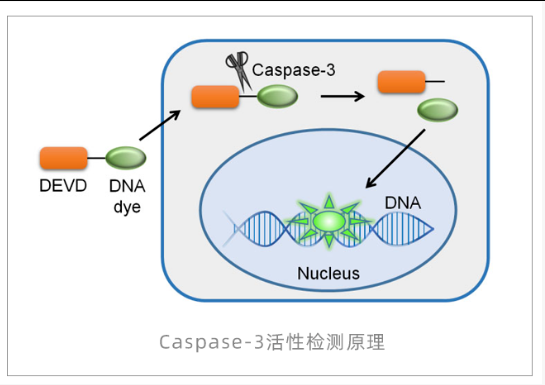
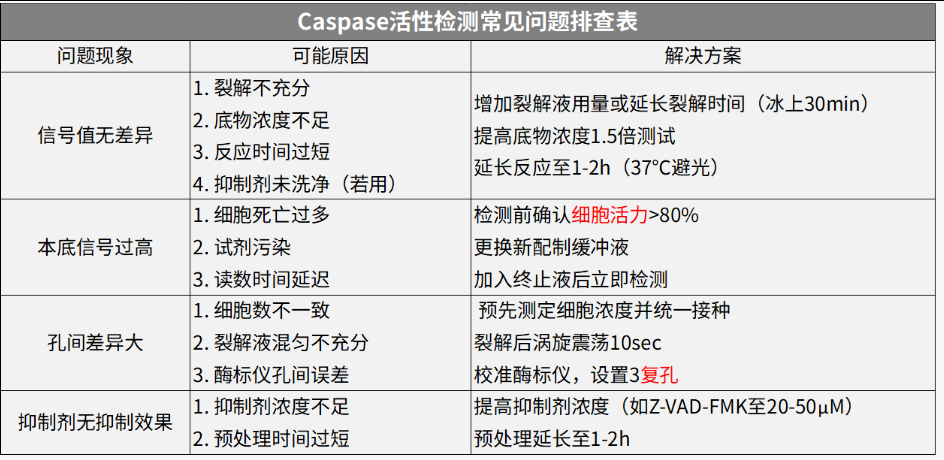
Caspase活性检测常见问题排查表
关键注意:
1、裂解后立即检测(Caspase易降解);2、设置不加底物空白对照;3、活性单位需用蛋白浓度校正。
WB检测切割
原理:抗体识别Caspase酶原(全长)和其活化片段(切割后小片段),或切割底物(如全长PARP vs 89kD片段)。
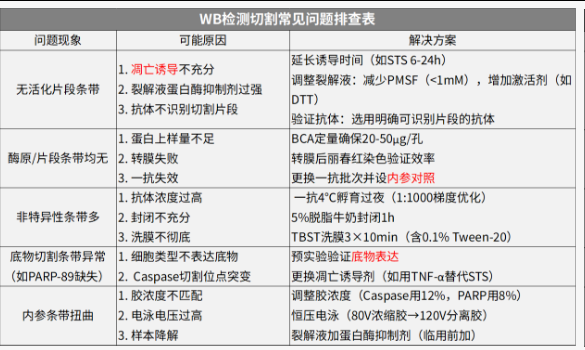
WB检测切割常见问题排查表
关键注意:
1、样本表达量;2、设置阳性对照,用凋亡诱导剂处理;3、内参对照确认实验体系正常。
晚期表型:结构崩解与“死亡印记”
现象:染色质凝聚、核碎裂、DNA片段化、凋亡小体形成。
检测方法:
TUNEL (DNA断裂)
原理:末端转移酶(TdT)将标记的dUTP连接到DNA断裂产生的3'-OH末端,直接标记凋亡细胞核。
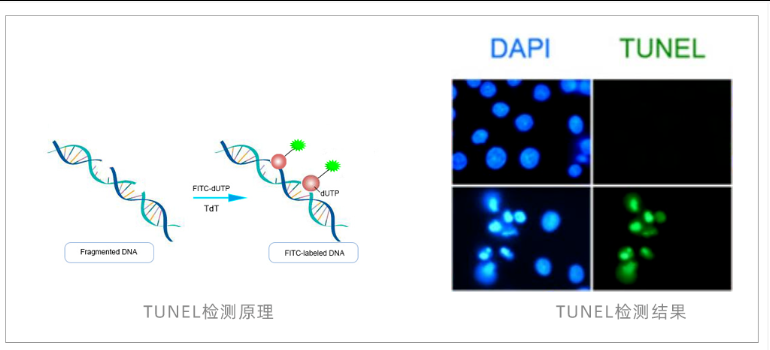
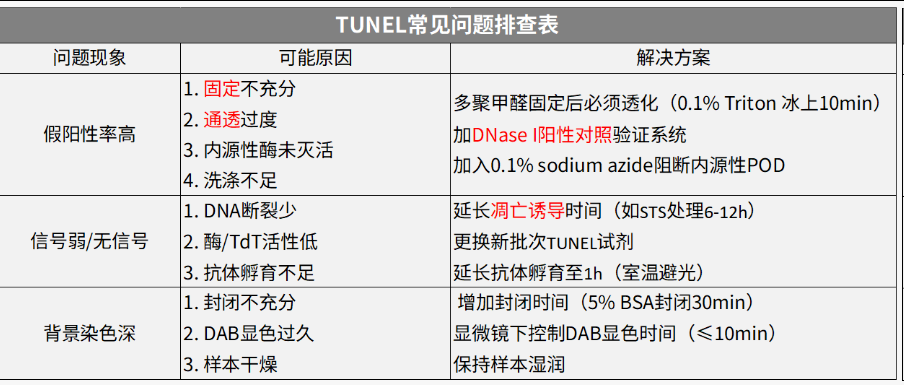
TUNEL检测常见问题排查表
关键注意:
1、固定时间≤30min(4% PFA);2、设DNase I处理阳性对照;3、荧光法需避光封片后立即拍摄。
形态学观察 (Hoechst 33342/DAPI/PI/电镜)
原理:染色DNA、高分辨率显微镜下直接观察凋亡特征。
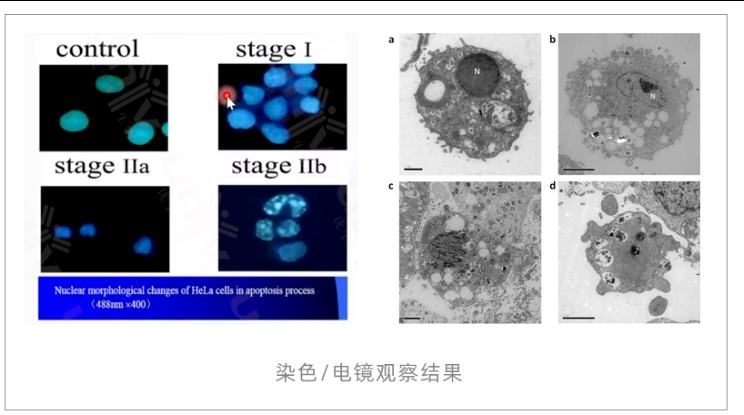
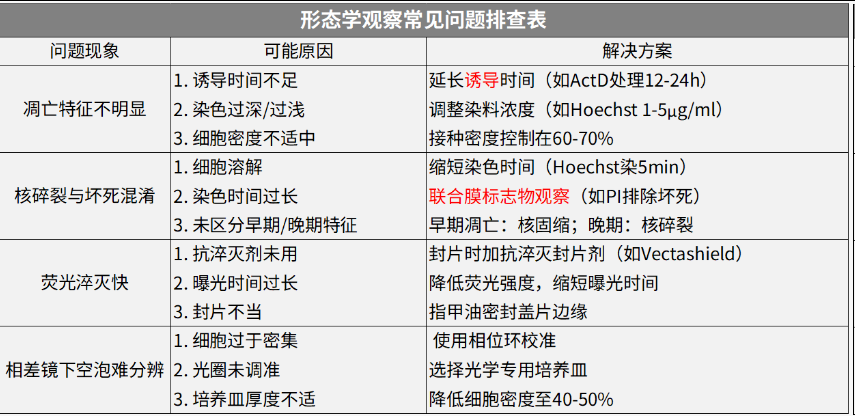
形态学观察常见问题排查表
关键注意:
1、凋亡诱导阳性对照(如星形孢菌素);2、联合染色:Hoechst(核形态)+ PI(膜完整性);3、拍摄时用100×油镜。
观察到明确的凋亡表型(如PS外翻、Caspase活化、核碎裂),我们便捕捉到了凋亡的“现象”。接下来需要追问的是——哪些关键分子在这个“死亡程序”中发生了显著变化?这引领我们进入差异表达分析阶段。
第三步
锁定差异—寻找凋亡的“关键分子”
表型确认后,目标是筛选在凋亡过程中表达或活性发生显著变化的关键分子。这些分子通常是凋亡通路的核心组件或调控因子。
筛选策略 :
靶向性筛选:基于凋亡通路知识及模型所选的诱导途径,利用WB、qPCR、免疫荧光(IF)等技术,检测途径特异性的已知关键分子差异:
❖
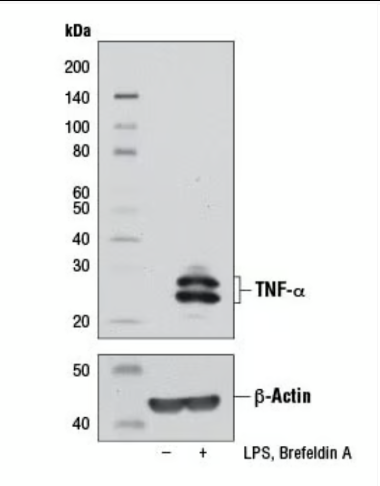
外源性途径:检测死亡受体(Fas, TNFR1)、配体(FasL, TNF-α)、接头蛋白(FADD)、Caspase-8/10的活化、cFLIP的表达/抑制。
❖
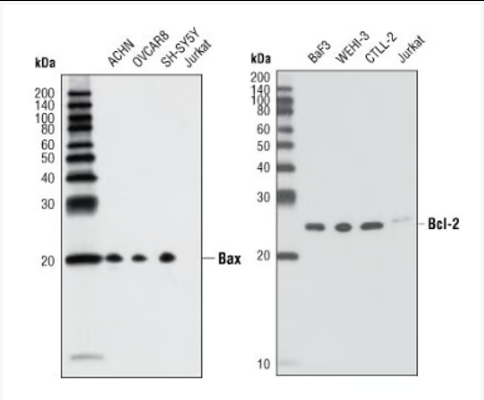
内源性途径:检测Bcl-2家族成员表达/比值(Bax, Bak, Bcl-2, Bcl-xL, Mcl-1, Bid切割tBid)、细胞色素C释放(胞浆组分)、Smac/DIABLO、AIF、Caspase-9活化。内质网应激相关:检测GRP78/BiP, CHOP, Caspase-12(人主要为Caspase-4)活化。
❖
穿孔素/颗粒酶途径:检测颗粒酶B (GrB)活性(可用特异性底物如IETD-AMC)、Bid切割(tBid)、Caspase-3直接活化(可能不依赖Caspase-8/9)。
❖
Caspase家族:检测特定Caspase(如Caspase-3, -7)的活化程度,及其主要底物(如PARP, ICAD)的切割。若使用抑制剂,需验证其有效性(抑制Caspase活性及下游事件)。
非靶向筛选:当研究新机制或复杂调控时,可采用组学方法(如转录组测序RNA-seq、蛋白质组学)全面筛选差异基因/蛋白。这是发现新调控因子的有力工具,后续需将差异分子锚定到具体的凋亡途径中进行分析。
聚焦核心分子:通过上述筛选,结合文献和通路背景,锁定1-2个变化最显著、功能最核心且与诱导途径关联性强的分子(如外源性模型中FADD显著聚集,内源性模型中Bax显著上调并转位,颗粒酶途径中GrB活性高且Bid被切割,Caspase抑制剂模型中凋亡被显著抑制)作为后续机制研究的突破口。
这里小优细节君也将部分关键靶点在WB实验中常见共性问题的优化Tips列在下方,供大家学习参考:
锁定了关键的差异分子(例如,在外源性模型中FADD募集增加,内源性模型中Bax线粒体转位明显,或颗粒酶途径中检测到活跃的GrB及tBid),研究便进入了最核心也最迷人的环节——机制解析。这些分子是如何被特定诱导剂调控的?它们又是如何在各自途径中相互作用,最终汇聚到凋亡执行的?
第四步
解析机制—深入凋亡的“控制中心”
此阶段旨在阐明关键差异分子在凋亡通路中的具体作用、上下游调控关系及其分子机制。
1
明确上下游关系:
操控关键分子:过表达、敲低/敲除、抑制剂/激动剂
检测下游效应:操控关键分子后,必须回溯到第二步的表型检测!观察其对凋亡标志物(PS外翻、ΔΨm、Caspase活性、核碎裂等)的影响,验证其功能及在途径中的位置。
2
探究作用机制:
相互作用验证:目标分子如何激活或抑制下游效应分子?
翻译后修饰研究:凋亡蛋白常受磷酸化、泛素化等修饰调控。
亚细胞定位变化:关键分子(如细胞色素C从线粒体释放到胞浆,Bax从胞浆转位到线粒体)的定位变化是重要的活化标志。
通路互作与动态验证:凋亡通路间存在交叉对话(如Caspase-8可切割Bid连接外源与内源通路)。
研究凋亡信号通路,是一个从宏观表型到微观机制的递进过程。多指标联合验证(如形态学+生化检测+分子互作)、严谨的对照设置(阳性/阴性/处理/抑制剂对照)和时间动力学分析,是贯穿始终、避免误读的关键原则。
通过这条清晰的“造模-表型-差异-机制”研究路径,结合对检测技术的娴熟运用与问题洞察,您将能更自信地拨开凋亡信号网络的迷雾,揭示细胞生命抉择背后的精密调控逻辑。
部分相关产品:
|
货号 |
名称 |
|
|
Caspase-3 (D3R6Y) Rabbit mAb |
|
|
Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb |
|
|
Bax (D2E11) Rabbit mAb |
|
|
Bcl-2 (D55G8) Rabbit mAb |
|
|
Apoptosis Antibody Sampler Kit |
|
|
S-RMab® Bcl-2 Recombinant Rabbit mAb (SDT-R160) |
|
|
BAX Recombinant Rabbit mAb (SDT-338-76) |
|
|
Caspase-3 Recombinant Rabbit mAb (S-656-43) |
|
|
|
|
|
Apoptosis MiniAb Set II |
|
|
UA-Glo® Caspase 3/7 Assay |
|
|
Annexin V-FITC/PI细胞凋亡检测试剂盒 |
|
|
TUNEL细胞凋亡试剂盒(绿色荧光) |
|
|
线粒体膜电位检测试剂盒(JC-1) |
|
|
Etoposide |
|
|
毒胡萝卜素 |
|
|
Z-VAD-FMK |
参考文章:
【小优细节君】Bax/Bcl-2经典凋亡相关蛋白的故事
【小优细节君】偶遇Caspase提问器
📚点此直达【文献中心】:超百万高质量文献数据,每月5万+持续更新!
想了解更多热门靶点WB技巧?
点此进入“小优细节君”专栏
获取往期干货内容,解锁WB小技巧!
小优细节君:把经验变成可复制的指南
“小优细节君”专栏内容由优宁维售后部主导输出,每月从超300例真实的售后咨询中筛选出科研人频繁遇到的共性问题,再而转化为可复制的实验指南。从热门靶点出发,解析机制原理、给出具体步骤、总结常见误区,帮助你把实验痛点拆解成可破解的细节!
专栏将持续更新,请关注“优宁维抗体专家”,实时掌握实验技巧!
推荐阅读:
+
+