PROTACs:常见问题全解答

PROTAC®降解剂以及相关化合物(如分子胶和LYTAC)是靶蛋白降解策略的基本工具。该领域的研究正在快速发展,从而能够开发出以前被认为是“不可成药”的疾病靶点疗法。这篇文章根据常见问题对PROTAC进行了概述。
1
什么是PROTAC?
PROTAC是蛋白水解靶向嵌合体(proteolysis-targeting chimera)的首字母缩略语。顾名思义,这类分子包含多个功能单元,用于靶向细胞内的特定蛋白质,以便其被细胞的垃圾处理系统(泛素-蛋白酶体系统或UPS)降解。典型的PROTAC由2个功能,由连接子分开的蛋白质结合单元或配基。
2
PROTACs如何工作?
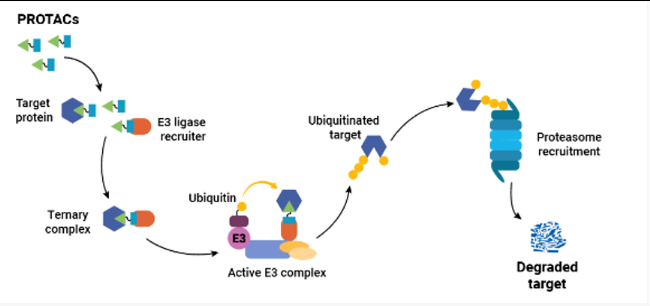
PROTAC的双功能特性对其在细胞内的工作方式至关重要。PROTAC的其中一个配体(有时被称为“弹头”)与目标蛋白结合。另一个配体(“锚”)与UPS机器的一个组分结合——通常是一种招募E3泛素连接酶的蛋白质。PROTAC同时结合这两种蛋白质形成三元复合物。一旦形成这种复合物,E3连接酶就会催化泛素残基依次添加到靶蛋白上。这条泛素链引起了UPS的注意,靶蛋白随后被降解。
经典PROTAC的作用机制概述
值得注意的是,PROTAC可以在靶蛋白泛素化后释放,所以其在此过程中可被循环利用。因此,相对少量的PROTAC可催化大量靶蛋白的降解。
3
为什么PROTACs很重要?
一旦靶蛋白被确定为与疾病相关,传统的药物发现策略就会集中寻找该蛋白的抑制剂。在许多情况下,这种方法涉及筛选小分子候选药物库,以识别那些可与靶蛋白上的活性位点结合并调节其活性的候选药物。这种“占位驱动药理学”方法有其局限性(1),尤其是对于没有酶活性的蛋白质。因此,大约有85%的已知蛋白靶标仍不可成药(2)。此外,即使存在合适的抑制剂,通常也需要高浓度的药物才能达到治疗效果(3)。
PROTACs克服了抑制剂驱动药物开发策略的缺点。其可以设计为在大多数蛋白靶标上结合多个位点,并且其催化作用机制允许对靶蛋白水平进行可逆的、浓度依赖性调节。在某些情况下,特别是在研究复杂的信号通路时,靶蛋白的降解可能比仅仅抑制其活性更具有优势。
4
PROTACs是如何被发现的?
首次报道的PROTAC是Craig Crews和Raymond Deshaies的实验室在2001年合成和测试的肽(4)。在这项概念验证研究中,PROTAC旨在将酶甲硫氨酸氨基肽酶-2(MetAP-2)靶向泛素连接酶复合物的一个组分。研究表明,Met-AP2以PROTAC依赖性方式被泛素化和降解,为未来的PROTAC开发奠定了基础。随后,基于肽的PROTAC被进一步应用,但这些分子经常因为细胞渗透性差而受阻(5)。
2008年发表了首个小分子PROTAC的成功应用(6)。该分子展现了良好的细胞渗透性,并以PROTAC浓度依赖性方式成功靶向降解了雄激素受体,表明其可应用于雄激素受体表达增加为特征的前列腺癌中。
自这些早期发现以来,PROTAC研究经历了指数级增长(综述见7)。目前,PROTAC的开发为传统基于抑制剂的小分子药物发现方法提供了一个令人兴奋的替代方案。根据PROTAC-DB(跟踪PROTAC开发的网络可访问数据库),截至2021年4月,有2258个PROTACs正在开发中。
5
如何设计有效的PROTAC?
在进行PROTAC的合理设计时必须考虑多种因素。虽然结构研究可以从晶体学数据中深入了解靶标的结合位点,但这些数据对于许多靶标或潜在PROTACs来说并不可用。因此,需通过探究靶蛋白降解过程各阶段的作用机制来驱动合理的PROTAC设计。Paiva和Crews对PROTAC设计的一般考虑因素进行了总结(8)。Leissing等人概述了结构引导的设计原则,强调了三元复合物的形成(9)。另一篇综述讨论了结构引导的PROTAC设计,以靶向与多种类型癌症相关的染色质重塑复合物(10)。
通常,PROTAC设计侧重于分子的每个组成部分:靶标结合配体或称为“弹头”、连接子和E3连接酶招募配体或称为“锚”。
靶标结合配体设计
在大多数情况下,PROTAC弹头将对其靶蛋白具有高亲和力。设计策略可以利用已知的小分子抑制剂,这些抑制剂已被广泛表征并对感兴趣的靶标具有特异性。然而,结合多个靶标的配体可能更具有优势,即使是对靶蛋白亲和力较弱的配体也可能在三体复合物形成时稳定下来,从而产生有效的靶标降解(11)。
PROTAC开发中一个有趣的发现是三价PROTACs的使用(12)。这些分子包括两个结合靶蛋白的配体,其可以增加对靶标的亲和力从而形成更加稳定的三元复合物并促进靶标降解。
连接子设计
PROTAC连接子在设计阶段往往被忽视,其重要性可能被低估。越来越多更复杂且功能更强大的连接子被投入使用,其对提高三元复合物稳定性和降解效率方面具有优势(综述见13)。连接子的组成和长度在优化PROTAC效率方面发挥着重要作用(14)。
E3配体设计
已知有超过600种E3泛素连接酶;然而,大多数E3连接酶招募配体的开发只针对其中的少数酶(15)。其中,最常见的是von Hippel-Lindau(VHL)E3连接酶和cereblon(CRBN)。一篇详细的综述提供了设计与此类酶和其他E3连接酶结合的配体时可用的合成途径(15)。该综述还提供了一个帮助选择合适配体的工具,以及用于开发E3配体的流行性、可商购的构件列表。
6
如何测试PROTAC是否可以在活细胞中工作?
存在多种生化检测可用于检查靶蛋白降解过程中的各个步骤;然而,传统方法通常只提供终点结果并且不适合高通量分析。活细胞检测对实时降解监测具有显著优势(16)。在这些检测中,基于NanoBRET™的方法提供了灵敏且方便的PROTAC动力学测量,以及对活细胞中复杂降解过程更广泛的理解(17)。NanoBRET™ VHL and CRBN Ternary Complex Starter Kits提供了一种简便的方法,可以在检测三元复合物形成的同时进行靶蛋白的定量降解。

NanoBRET技术在靶标结合应用中的概述。
7
PROTACs是否用于临床应用?
2019年,Arvinas, Inc.开发了首个进入临床试验的PROTAC,用于治疗前列腺癌。2022年2月,该公司报告了中期结果,指出了PROTAC,ARV-110或bavdegalutamide“在转移性去势抵抗性前列腺癌(mCRPC)中持续提供抗肿瘤活性且使患者获益的证据”。在与辉瑞公司的合作中,Arvinas还报告了另一种PROTAC,ARV-471,以及其在治疗乳腺癌方面的初步成果。PROTACs和相关降解剂正在靶向其他类型的癌症(综述见18、19)。临床前研究中一个有前景的发展是使用PROTACs靶向KRAS引发的癌症,其历来很难进行有效靶向(20)。
向下滑动查看所有内容
Promega的完整PROTAC功能验证方案,为您回答研发中的关键性问题,加速您的PROTAC分子研发进程:

PROTAC技术资料

Promega助力PROTAC药物发现视频讲座


