靶向蛋白水解嵌合体(proteolysis-targeting chimeras, PROTACs)是一种双功能小分子,包含两种不同的配体,一种与E3连接酶结合,另一种与目标蛋白质(POI)结合,通过化学连接子连接在一起。PROTAC使两个蛋白接近并形成三元复合物。E3连接酶将招募E2结合酶,并将目标蛋白在特定位点上聚合泛素化。多泛素化将使POI参与细胞蛋白酶体的降解机制,而PROTAC(未被蛋白酶体降解)将从复合物中解离,并将与新的靶蛋白启动新的催化循环。
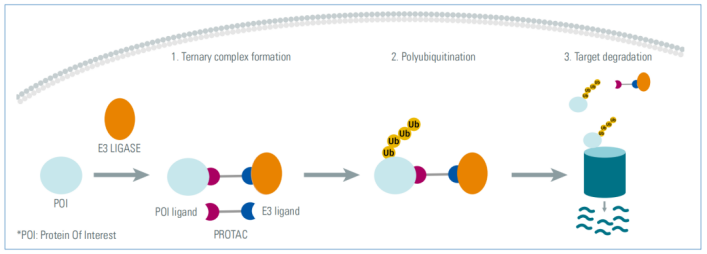
图1. PROTAC降解靶蛋白的催化作用模式
01
PDL1-PROTAC-CRBN三元复合物
程序性死亡配体1 (Programmed death-ligand 1, PD-L1)是肿瘤中最重要的免疫逃逸机制之一。B.Cheng等人基于间苯二酚二苯醚(一种抑制PD1-PDL1相互作用的小分子)设计了PROTAC分子,选择pomalidomide作为E3连接酶CRBN的配体,合成了一系列新的PROTAC分子。他们研究了靶蛋白配体和连接子的优化。
作者使用了三种不同的靶蛋白配体:BMS-8、BMS-1233和BMS-1198。在不同的化合物中分别使用了刚性或柔性连接子,并测试不同的连接子长度。最终作者得出结论:BMS-8靶蛋白配体系列可以抑制PD-1/PD-L1相互作用。具有刚性连接子哌嗪的化合物IC50值更低,比柔性接子更有利于抑制PD-1/PD-L1。作者进一步研究连接子长度对PROTAC化合物活性的影响发现,链较短的化合物(< 6个原子)的IC50更小。
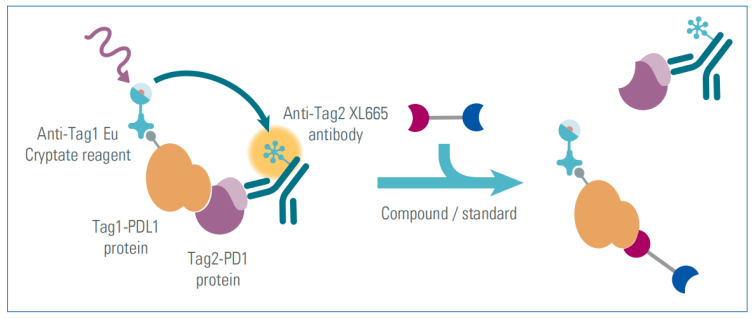
图2. HTRF检测原理
02
BTK-PROTAC-CRBN三元复合物
布鲁顿酪氨酸激酶(BTK)是B细胞受体(BCR)途径的一部分。它是B细胞增殖和存活的重要调节因子,调节分化和信号传导等过程。Zorba, a .等人设计了PROTAC使BTK参与E3连接酶CRBN介导的蛋白酶体降解过程。作者合成了一个包含11种不同长度的PEG连接子的化合物库。该文库分为两类:短连接子(化合物1~4,有5~9个原子连接)和长连接子(化合物6~11,有14~20个原子连接)。
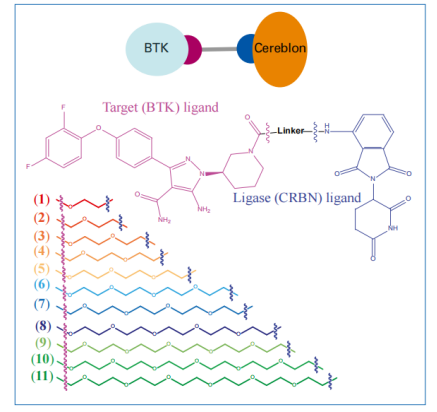
图3. BTK和CRBN的11个不同连接长度的PROTACs
为了评价连接子长度对(target-PROTAC-E3连接酶)三元复合物的影响,筛选最有效的PROTAC,作者建立了体外HTRF实验。重组生物素化的BTK和CRBN蛋白分别与链霉亲和素供体和受体偶联物孵育。
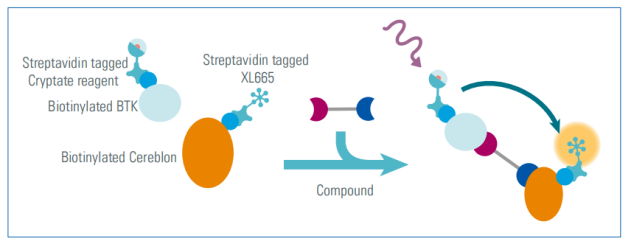
图4. HTRF试验原理
CRBN-PROTAC-BTK呈钟形剂量-响应曲线,这与三元复合物平衡一致,在三元复合物平衡中,过量的连接子会抑制三元复合物的形成。较长的PROTACs(连接子6-11)观察到类似的结合亲和力,较短的PROTACs具有较低的结合亲和力。此外,具有短连接子的PROTAC化合物(化合物1-4)在体外形成的三元复合物比较大连接子形成的化合物(6-11)要少得多。虽然化合物(9)和(11)似乎分别产生最大的峰值和最有效的复合物形成,但通过后续的试验发现,在细胞中化合物(10)对BTK的降解效果最好。这可能反映了上述 FRET检测的局限性,也可能反映了物理特性或细胞渗透性的细微差别,而这些都是细胞检测中的隐含因素。
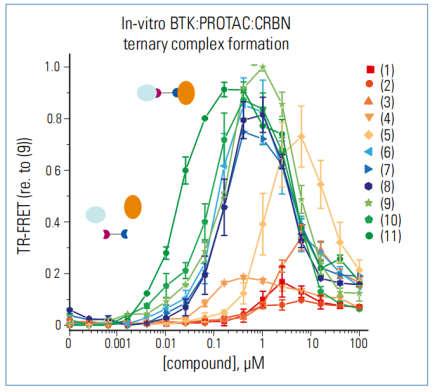
图5. 评价连接子长度对三元复合物形成的影响
03
BRD4-PROTAC-E3连接酶三元复合物
BRD4是一种转录和表观遗传调控因子,其失活或下调可抑制癌症的发展。Wurz, R.P.等人开发了一种点击化学方法,利用CRBN或VHL作为E3连接酶,靶向含溴结构域蛋白4 (BRD4),开发了12个新的PROTACs。为了评估PROTACs是否可以形成三元复合物,利用AlphaScreen技术开发了一种放大发光接近均相分析。将GST标记的BRD4蛋白和poly-His标记的E3连接酶镍螯合物与谷胱甘肽供体珠和AlphaScreen受体珠混合,通过三元复合物形成捕获E3连接酶结合的受体珠和BRD4结合的供体珠靠近时产生的发光。
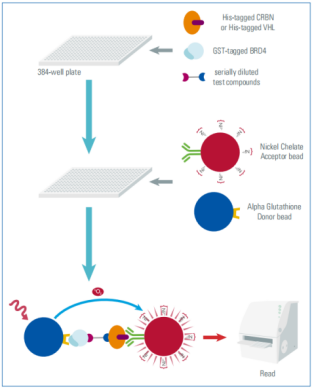
图6. AlphaScreen试验原理
结果表明,大多数合成的PROTACs都能诱导三元复合物的形成,用VHL配体构建的PROTAC化合物在全局上表现出更有效的三元复合物形成。此外,在细胞实验中,作者观察到具有最长连接的化合物(化合物11e)是最活跃的。同时也证明了使用AlphaScreen法可以很容易地区分化合物。
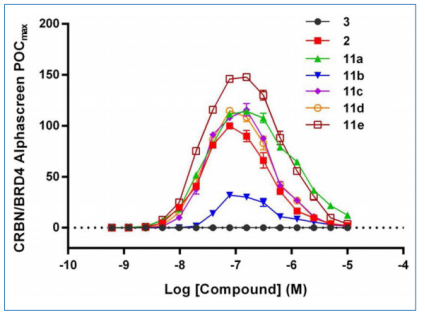
图7. CRBN/BRD4 PROTACs的接近性分析数据
参考文献:
1. Cheng, B. et al. (2020). Discovery of novel resorcinol diphenyl ether-based PROTAC-like molecules as dual inhibitors and degraders of PD-L1. European Journal of Medicinal Chemistry, 199, 112377
2. Wurz, R.P. et al. (2018). A “Click Chemistry Platform” for the Rapid Synthesis of Bispecific Molecules for Inducing Protein Degradation. Journal of Medicinal Chemistry, 61(2), 453–461.
3. Zorba, A. et al. (2018). Delineating the role of cooperativity in the design of potent PROTACs for BTK. Proceedings of the National Academy of Sciences, 115(31), E7285–E7292.
来源于优宁维药物研发官网

