如何应对靶向药物的耐药性是治疗肺腺癌(LADC)患者的主要临床挑战,作者在患者的一个亚组中发现,EGFRT790M阴性,EGFRG724S阳性亚克隆与奥西替尼耐药性之间存在关联。因此,作者对此突变进行了系统的生化、细胞和结构分析,以确定该突变在靶向EGFR抑制的功能相关性。
01
EGFRG724S与癌症进展有关
在LADC再活检项目中,作者对在第三代EGFR抑制剂治疗下进展的病变进行了靶向测序,在开始第三代EGFR抑制剂治疗之前,发现了两例未检测到EGFRG724S的患者(P1, EGFRE746_S752delinsV;P2, EGFRS752_I759del)和2例EGFRG724S低水平突变(P3, EGFRE746_T751delinsIP;P4, EGFRE746_T751delinsIP)。对病人用不同激酶抑制剂进行治疗后发现,EGFRG724S突变可能在奥西替尼耐药克隆中出现或持续存在,这些克隆可能与EGFRT790M突变独立进化。研究数据进一步表明,在第三代EGFR抑制下,EGFRG724S和EGFRT790M的等位基因频率呈负相关,EGFRG724S频率增加的同时,EGFRT790M频率降低(图1)。
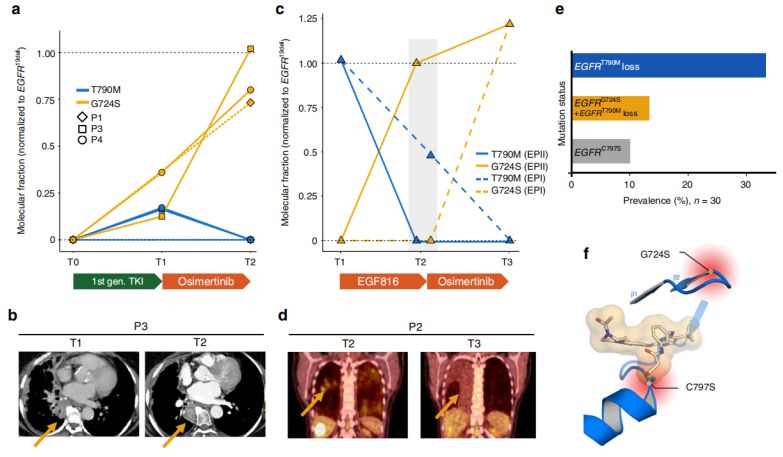
图1
02
EGFRG724S介导了对第三代EGFR抑制剂的耐药性
为了测试所鉴定的EGFR突变的功能相关性,作者在NIH-3T3细胞中过表达了EGFRG724S和EGFR19del突变的不同组合。使用厄洛替尼,奥西替尼和罗西替尼治疗后,EGFR19del突变细胞中磷酸化EGFR水平的显著降低,但在单独表达EGFRG724S和EGFR19del+G724S的细胞中没有降低(图2a, b)。并且在单独过表达EGFR19del或EGFRG724S以及这些突变组合的Ba/F3细胞中,发现只有EGFR19del对厄洛替尼和奥西替尼表现出高敏感性(图2c, d)。接下来作者采用小鼠异种移植模型,将转基因NIH-3T3细胞皮下注射到裸鼠(NCRnu/nu)中,观察到双突变EGFR19del+G724S和单突变EGFR19del 的NIH-3T3细胞都能形成肿瘤(图2e)。奥西替尼治疗显著减缓了EGFR19del 的NIH-3T3细胞的肿瘤生长,但对于双突变EGFR19del+G724S 的NIH-3T3细胞中与用载体处理的肿瘤相比,几乎没有治疗效果(图2e, f)。且在奥西替尼治疗后,携带EGFR19del突变的裂解caspase-3阳性细胞和Ki67阳性细胞的显著减少,而EGFR19del+G724S不明显。这些结果表明EGFRG724S点突变可能赋予对第三代EGFR抑制剂的耐药性。
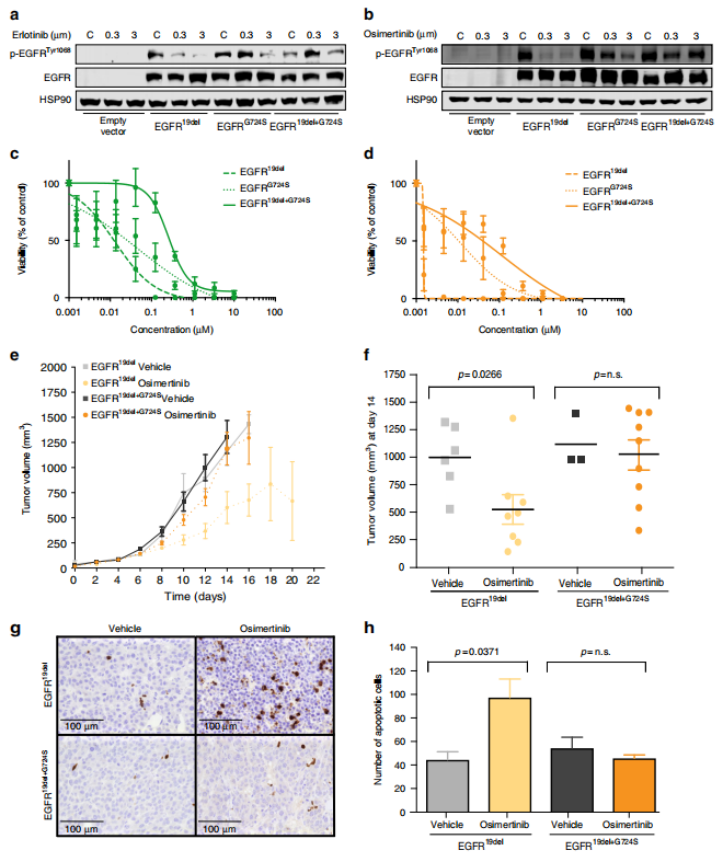
图2
03
富含甘氨酸环构象改变对结构的影响
富含甘氨酸的环是底物和配体结合的关键结构元件。富含甘氨酸环的突变可以干扰配体结合,从而介导对激酶抑制剂的耐药性。为了评估EGFRG724S突变对EGFR激酶的结构影响,作者对罗西替尼与EGFR结合的共晶结构(PDB ID: 5UWD)进行了结构分析发现,富含甘氨酸的环可以以与第三代抑制剂结合不相容的构象存在(图3a,b)。分子动力学(MD)模拟(基于PDB ID:4ZAU)33显示,与模拟的野生型蛋白结合时相比,EGFRG724S中的ELREA基序发生了改变(图3c)。此外,在724位引入丝氨酸导致螺旋αC、ELREA基序和富甘氨酸环形成的网络具有高度的动态灵活性,由确定的均方根波动(RMSF)值所代表, 这些增强的波动向奥西替尼的甲基吲哚残基延伸。作者额外模拟了相应的EGFR19del和EGFR19del+G724S系统(图3d)发现,相对于EGFR19del, EGFR19del+G724S的调节网络中富G环的灵活性增加也很明显。突变的Ser724侧链似乎使调控网络更加灵活,并诱导了富G环的构象发生改变。综上所述,作者得出结论,EGFRG724S突变可能引发与配体结合不相容的富含甘氨酸环的构象,导致第三代EGFR抑制剂的结合效率降低。
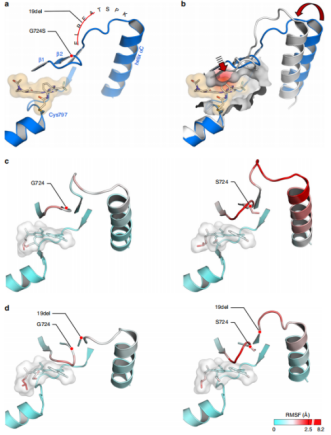
图3
04
通过EGFRG724S改变EGFR抑制剂活性模式
接下来,作者研究了EGFRG724S突变是否会直接干扰第三代EGFR抑制剂与EGFR激酶结合能力的问题。作者检测到与EGFR19del单突变蛋白相比,使用奥西替尼对双突变EGFR19del+G724S进行激酶测定时,IC50值显著增加(图4a)。在筛选针对单突变和双突变的EGFR激酶的抑制剂时,作者观察到两种抑制剂活性模式:(i)除了EGFR19del突变外,EGFRG724S突变的引入会诱发对几乎所有临床使用的第一代和第三代抑制剂的耐药性;(ii)所有第二代抑制剂对EGFR19del+G724S双突变激酶仍有活性(图4b)。此外,作者还发现了一种基于氨基吲哚的抑制剂,对双突变激酶具有低纳摩尔活性,它不属于第二代EGFR抑制剂,表现出与奥西替尼不同的结合模式(图4b)。作者在细胞模型测试中发现,EGFRG724S突变细胞在低纳摩尔浓度下基本上保留了对阿法替尼的敏感性(图4c,d)。基于以上数据证明,EGFRG724S突变诱导对第三代和第一代EGFR抑制剂产生耐药性,但对基于4-氨基喹唑啉的第二代EGFR抑制剂保持敏感性(图4e)。
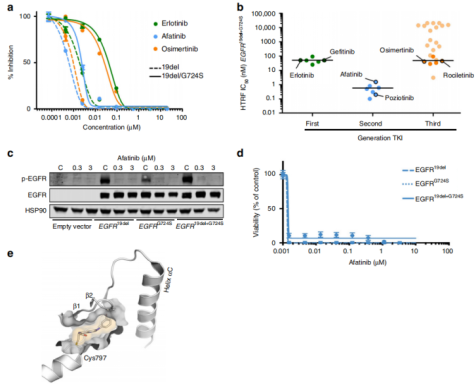
图4
05
EGFRG724S降低第三代EGFR抑制剂的结合
作者进一步评估了结合动力学,包括动力学参数Ki和kinact(失活率)的测定(图5a)。作者在实验中发现第二代和第三代EGFR抑制剂与EGFR突变体的结合特性存在显著差异。第二代EGFR抑制剂阿法替尼和结构相关抑制剂波齐替尼对EGFRWT、EGFR19del和EGFR19del+G724S激酶表现出恒定的亲和力和结合动力学(图5b,c)。此外数据显示,在所有EGFRG724S阳性克隆富集的复发肿瘤中观察到,EGFRT790M的缺失进一步促进了第三代EGFR抑制剂的亲和力丧失。第三代抑制剂被设计为针对790位的蛋氨酸gatekeeper残基,而第二代抑制剂阿法替尼和波齐替尼对携带苏氨酸的EGFR变体表现出更明显的亲和力。作者测试了阿法替尼和奥西替尼抑制磷酸化EGFR的能力发现,即使在1µM浓度下,奥西替尼也不能降低表达EGFR19del+G724S的NIH-3T3细胞中的磷酸化EGFR水平。与此相反,阿法替尼在这些细胞中与EGFR19del细胞一样有效地减少了磷酸化EGFR水平(图5d)。研究数据表明,在EGFRG724S突变激酶中,第二代EGFR抑制剂的可逆结合优于第三代EGFR抑制剂,因此可能克服EGFRG724S驱动的耐药性。
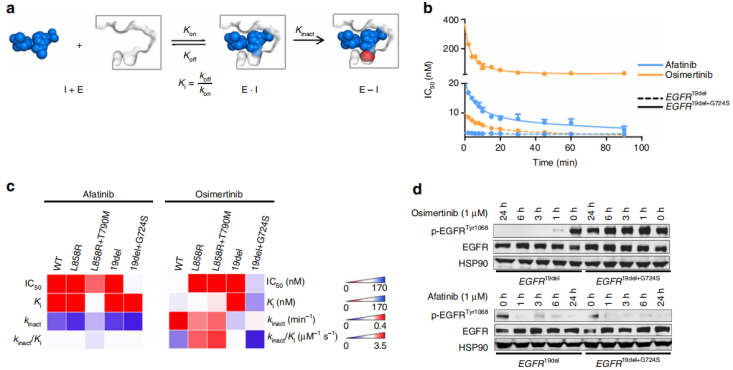
图5
06
EGFRG724S对第二代EGFR抑制剂敏感
作者测试了阿法替尼和奥西替尼对EGFR19del和EGFR19del+ G724S细胞的影响,结果发现两种药物对EGFR19del均有抑制效果,但在EGFR19del+ G724S突变细胞中,阿法替尼的生长抑制作用明显更高(图6a, b)。作者采用了小鼠异种移植模型进一步评估EGFRG724S和EGFR19del+G724S在体内对第三代EGFR抑制剂的敏感性发现,阿法替尼治疗显著减缓了单突变EGFR19del和双突变EGFR19del+G724S异种移植物的肿瘤生长(图6c,d)。总的来说,本文研究结果表明,EGFRG724S突变引起对第三代抑制剂的耐药性,而对第二代EGFR抑制剂没有影响。
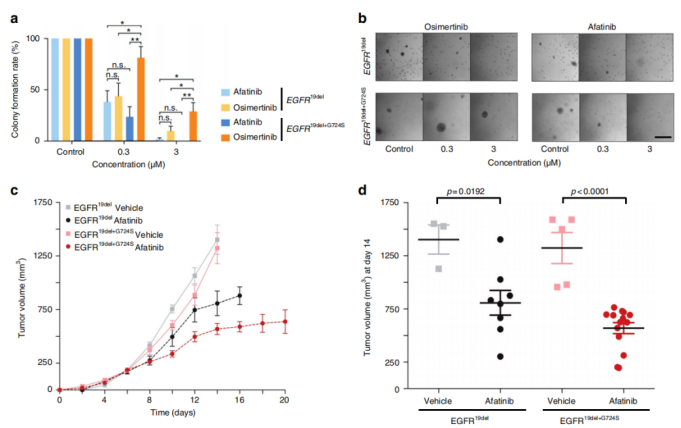
图6
参考文献:
Fassunke, J., Müller, F., Keul, M. et al. Overcoming EGFRG724S-mediated osimertinib resistance through unique binding characteristics of second-generation EGFR inhibitors. Nat Commun 9, 4655 (2018). https://doi.org/10.1038/s41467-018-07078-0.
来源于优宁维药物研发官网

