宿主细胞蛋白(HCP)污染是活细胞中生产的生物制药产品的主要问题。目前生物制药常用的宿主细胞有中国仓鼠卵巢细胞(CHO):用于抗体药或者重组蛋白的生产;人胚胎肾细胞HEK293:用于细胞和基因治疗病毒载体的生产,之前我们介绍过Astrea Bioseparations 复合型填料HCPure在抗体药生产工艺中去除CHO 宿主细胞蛋白残留的应用,今天我们给大家介绍一下HCPure在AAV生产工艺中HEK293宿主细胞蛋白去除的应用。
相对于CHO表达体系——目的蛋白分泌到培养基,AVV在HEK293细胞的生产,工艺更具挑战性。AAV通常在悬浮细胞中表达,其中病毒颗粒在宿主细胞内产生,这与直接表达到细胞培养上清液中的重组蛋白不同,需要一个裂解步骤,从而增加了要去除的杂质复杂性,包括HCP,HCDNA,各种添加剂和细胞碎片。
从AAV制剂中去除的关键杂质之一是不含遗传有效载荷的空AAV颗粒以及宿主蛋白,这些杂质对治疗期间的免疫反应产生不利影响。通过色谱法去除这些物质的最常见方法是使用离子交换,但亲和后pool中的任何带电杂质都会使使离子交换更加困难。
为了达到法规的纯度水平,需要利用各种结合相互作用的中间纯化步骤来捕获和去除存在的杂质。HCPure™配体以氢键和疏水z作用为主,对于亲和,阳离子交换(CEX)或阴离子交换(AEX)纯化工艺,提供了一种全新的正交色谱分离模式。
此前,HCPure™已成功用于不同的抗体纯化,包括CHO和大肠杆菌表达系统。我们还评估了HCPure™在细胞和基因治疗应用中的性能,特别是AAV衣壳中的杂质去除。
HEK293原料中AAV2衣壳的纯化一般使用市售泛血清型AAV树脂的亲和捕获纯化。然而,仅这一步骤并不能提供纯度要求,需要进一步精纯以去除宿主细胞杂质。
初次捕获后,将洗脱池调节至pH 7.2,含有350 mM NaCl,缓冲液用于长期储存AAV衣壳。5x10^13 个病毒颗粒以流穿模式通过 HCPure™ 宿主细胞蛋白清除树脂,该树脂装在 10 cm 床高、10 mm SNAP® 柱中。
使用SDS-PAGE进行分析,以比较样品和流穿组分(图1)。如我们所见,流穿组分分要干净得多,洗脱液组分包含大部分低分子量条带,而与3种病毒蛋白对应的条带很少。色谱柱的回收率极好,洗脱液中病毒含量极低。对样品进行ELISA分析,AAV2的回收率为100%,在低pH高盐带中检测到0.9%,在本分析的误差范围内。

图1.SDS-PAGE 显示每个流穿液中的杂质去除和无污染洗脱液。
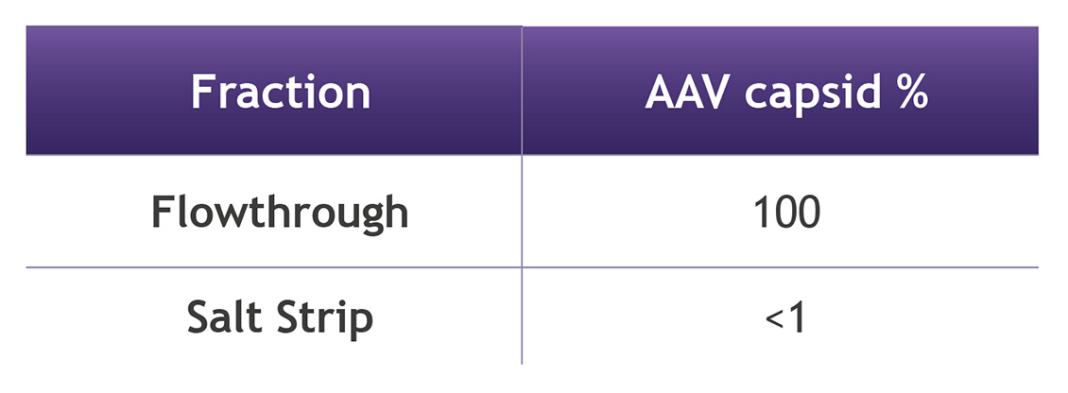
图2.AAV衣壳回收率。
去除HCP并保持产品纯度是实现有效治疗结果的关键。未能有效清除最终样本中的宿主细胞污染可能导致负面影响,包括患者治疗效果和免疫原性反应的变化。通过在亲和捕获步骤后使用HCPure™,可以有效去除宿主细胞污染,同时仍能实现高AAV衣壳产量。
总之,从人类细胞系中生产AAV面临着与杂质去除有关的挑战,特别是宿主细胞蛋白(HCP)。HCPure™ 通过利用氢键和疏水性相互作用来捕获和去除广泛杂质,为这些挑战提供了强大的解决方案。通过在亲和捕获步骤后使用HCPure™,研究人员可以获得高产量的纯AAV衣壳,不受宿主细胞污染。这对于基于AAV的基因疗法的安全性和有效性至关重要,可确保患者获得预期的治疗效果而没有副作用。
来源于优宁维药物研发官网

