肥胖症(obesity)是一种以体内脂肪过度蓄积和(或)分布异常,往往伴有体重增加,一种由遗传、内分泌和环境等多种因素共同作用而导致的慢性代谢性疾病。肥胖会增加患2型糖尿病和心脏病的风险,也会影响到骨骼健康和生殖系统,并增加罹患某些癌症的风险。6月25日,国家药品监督管理局(NMPA)批准了诺和诺德公司研发生产的诺和盈(用于长期体重管理的司美格鲁肽注射液)在中国的上市申请。此次获批,意味着未来司美格鲁肽可以“名正言顺”用于体重管理。然而,“网红减肥药”司美格鲁肽的副作用“司美脸”近日却在国外迅速刷屏:由于减重过快导致大量肌肉流失,进而出现面部凹陷、面部体积减少等不良外观。大家也意识到减重并非一日之功,减肥药的使用需要慎之又慎。今天小优带大家了解肥胖症的病因、相关信号通路以及现有减肥药物的治疗机制。
肥胖症病因
❖
生理:大脑控制饮食行为和食欲
❖
遗传:体重约有40-70%取决于基因组成
❖
心理:压力和心理困扰影响食欲
❖
社会:健康、社会和经济不平等
❖
药物:一些药物会导致体重长期增加
❖
环境:不健康的饮食模式和久坐的生活方式
肥胖症相关信号通路汇总
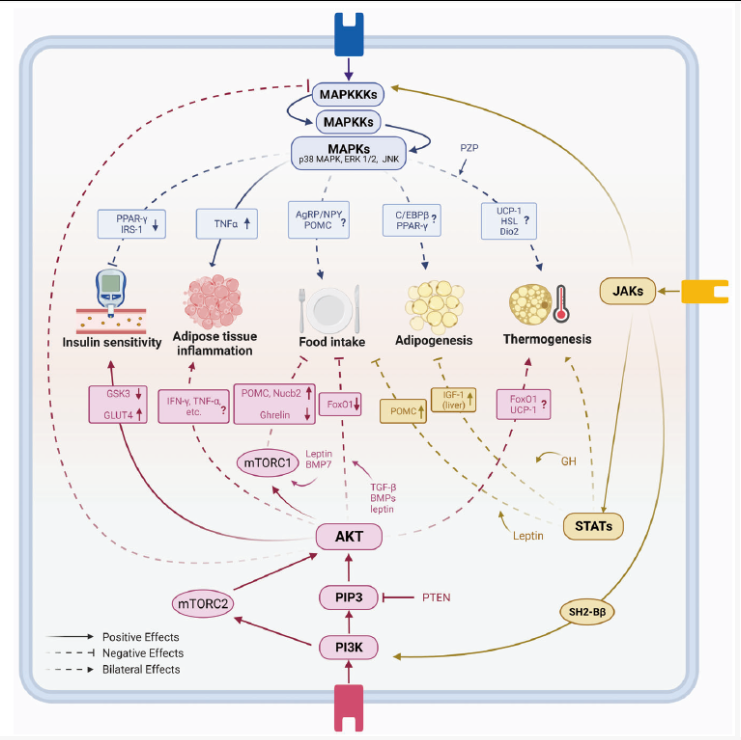
图1 MAPK、PI3K和JAK/STAT信号通路在肥胖发病机制中的作用[1]。
❖
MAPKs的激活会诱发肥胖中的脂肪组织炎症,还可以通过直接灭活胰岛素受体底物1(IRS1)和间接灭活PPAR-γ(过氧化物酶体增殖物激活受体)导致肥胖中的胰岛素抵抗。
❖
淋巴细胞中的PI3K-AKT信号传导可减少脂肪组织炎症以对抗肥胖,髓系细胞中则相反。此外,PI3K-AKT-mTOR信号负向调节食物摄入。
❖
JAK-STAT通路参与瘦素介导的厌食作用。在肝脏中,JAK-STAT信号的激活与脂肪的积累呈负相关。
肥胖症的治疗方法
肥胖管理的基础是生活方式干预(饮食习惯、体育锻炼);除此之外,还有减肥药物、减肥手术。小优在这里主要给大家介绍用于肥胖症的治疗药物及其治疗机制。
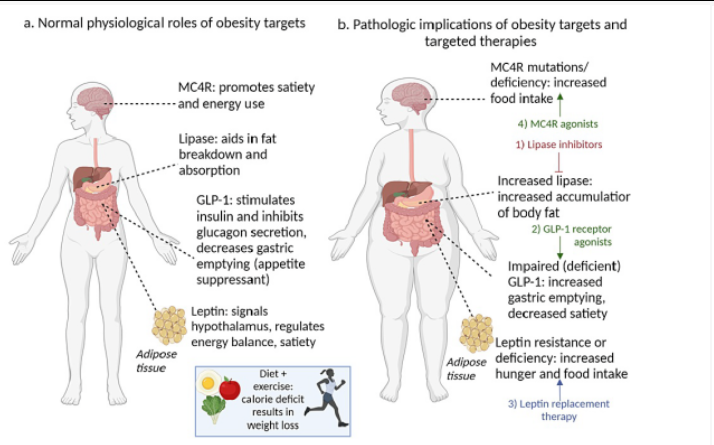
图2 肥胖靶点和抗肥胖疗法的生理和病理作用[2]。
(A)肥胖靶点的正常生理作用。(B)肥胖靶点和肥胖疗法的病理作用。
MC4R激动剂
MC4R是一种G蛋白偶联受体,由MC4R基因编码。MC4R突变是目前导致肥胖的主要单基因原因。MC4R基因中的150多个突变(包括移码、无义和错义)与肥胖有关。这些基因突变的总和导致MC4R功能整体下降,从而导致肥胖[3]。MC4R激动剂可刺激食欲减少,是肥胖患者(具有MC4R基因突变)的理想治疗靶点。赛美拉肽(Setmelanotide)是一种强效MC4R激动剂,已被证明可导致阿片黑素皮质素原(POMC)或瘦素受体(LEPR)基因突变相关肥胖患者体重减轻[4]。赛美拉肽用于减肥时的副作用主要是:注射部位反应、过敏反应、消化系统问题等。
|
货号 |
产品名称 |
|
|
Setmelanotide |
|
|
Setmelanotide |
注意:文中所涉及产品仅作科研实验使用,不支持临床等研究
脂肪酶抑制剂
在自然状态下,脂蛋白脂肪酶是一种多功能酶,可消化脂肪和脂类,将脂肪水解为脂肪酸和甘油,促进脂肪吸收,并维持胆囊功能。脂肪酶对脂肪分解和吸收的促进作用使其成为肥胖症的重要诱因。脂肪酶的功能是将甘油三酯从血液循环中清除并增加脂肪的吸收;因此,体内脂肪的积累来自于水解甘油三酯的分布。这意味着,脂肪酶抑制剂药物奥利司他(orlistat)和新利司他(cetilistat)有可能用于治疗肥胖症。奥利司他于2007年获得美国食品及药物管理局的非处方药批准,用于肥胖患者的减肥,而新利司他尚未获得美国食品及药物管理局的批准。新利司他于2013年在日本获得批准,用于有合并症的肥胖患者的减肥[5]。奥利司他和新利司他在减肥方面的副作用主要集中在胃肠道:脂肪泻、胃肠道不适等。
|
货号 |
产品名称 |
|
|
orlistat |
|
|
orlistat |
|
|
Cetilistat |
|
|
Cetilistat |
基于胰岛素的肥胖症治疗药物
胰高血糖素样肽1(GLP-1)、葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素受体激动剂最初是为治疗2型糖尿病而开发的,如今也可用于治疗肥胖症。
血糖水平通常在进食后升高,空腹时下降。进食后,作为细胞能量重要来源的葡萄糖被释放到血液中,使血糖水平升高。为了刺激餐后胰岛素的分泌,人体利用了肠道中产生的两种增量激素:胰高血糖素样肽1(GLP-1)和葡萄糖依赖性促胰岛素多肽(GIP)[6]。这些激素在进食后释放,刺激胰腺分泌胰岛素,向细胞发出吸收葡萄糖作为能量或储存葡萄糖的信号,从而降低餐后血糖水平的升高。除了刺激胰岛素分泌外,GLP-1(而非GIP)还能通过复杂的中枢和外周途径减缓胃排空、减少肠道蠕动、减少食物摄入量和食欲,并刺激胰高血糖素依赖性能量消耗。
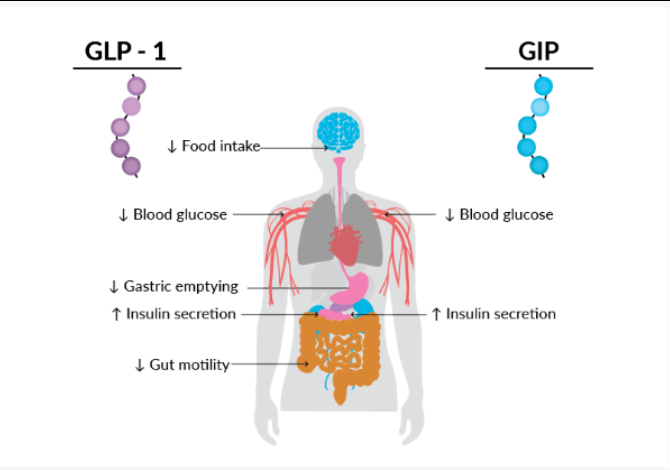
图3 GLP-1和GIP在血糖稳态和减肥中的作用总结
|
货号 |
产品名称 |
|
|
GLP-1 (7-36) amide (trifluoroacetate salt) |
|
|
GLP-1 (7-37) acetate |
|
|
Glucose-dependent Insulinotropic Polypeptide (human) (trifluoroacetate salt) |
01
单一激动剂
司美格鲁肽(Semaglutide)是一种GLP-1R激动剂,是GLP-1的多肽类似物,最初,其被批准用于降血糖。司美格鲁肽以葡萄糖浓度依赖的方式增强胰岛素分泌、抑制胰高糖素分泌,并能够延缓胃排空,通过中枢性的食欲抑制来减少进食量,从而达到降低血糖和减重的作用。研究表明,与单纯改变生活方式相比,司美格鲁肽作为减少热量摄入和增加体育锻炼等生活方式改变的辅助药物,可帮助肥胖症患者实现更大的体重减轻[7]。然而,包括司美格鲁肽在内的GLP-1激动剂存在一定的不良反应,与胰腺炎、胃轻瘫以及肠梗阻等胃肠道疾病风险的增加有关。近日来袭的“司美脸”又给司美格鲁肽用于减肥的适应症一记重创。
更多GLP-1R激动剂:
|
货号 |
产品名称 |
|
|
Semaglutide |
|
|
Sermaglutide |
|
|
Exendin-4 (48-86) amide (acetate) |
|
|
Lixisenatide (acetate) |
|
|
Lixisenatide Acetate |
02
双重激动剂
Tirzepatide是一种GLP-1R和GIPR双重激动剂[8]。虽然单用GIP似乎不会延迟胃排空或改变食物摄入量和食欲,但GLP-1R和GIPR激动剂具有协同作用,与单用GLP-1R激动剂相比效果更显著[9, 10]。Tirzepatide相关的不良反应可能包括恶心、腹泻、呕吐、便秘、腹部(胃)不适和疼痛、注射部位反应、疲劳、超敏(过敏)反应(典型的是发热和皮疹)、打嗝、脱发和胃食管反流病等。
|
货号 |
产品名称 |
|
|
Tirzepatide (sodium salt) |
03
三重激动剂
尽管GCGR激动剂具有高血糖作用,但它能通过刺激产热作用促进饱腹感并增加能量消耗,使其成为治疗肥胖症的潜在补充[11]。GCGR激动剂的高血糖作用可以通过加入刺激胰岛素分泌的药物来抵消,从而降低血糖水平,使GLP-1R和/或GIPR激动剂的多激动剂配方成为一种治疗肥胖症的新方法。事实上,三重GLP-1R、GIPR和GCGR激动剂瑞他鲁肽(retatrutide)已在临床试验中显示出良好的前景[12]。
|
货号 |
产品名称 |
|
|
Retatrutide (sodium salt) |
|
|
Retatrutide |
参考文献:


